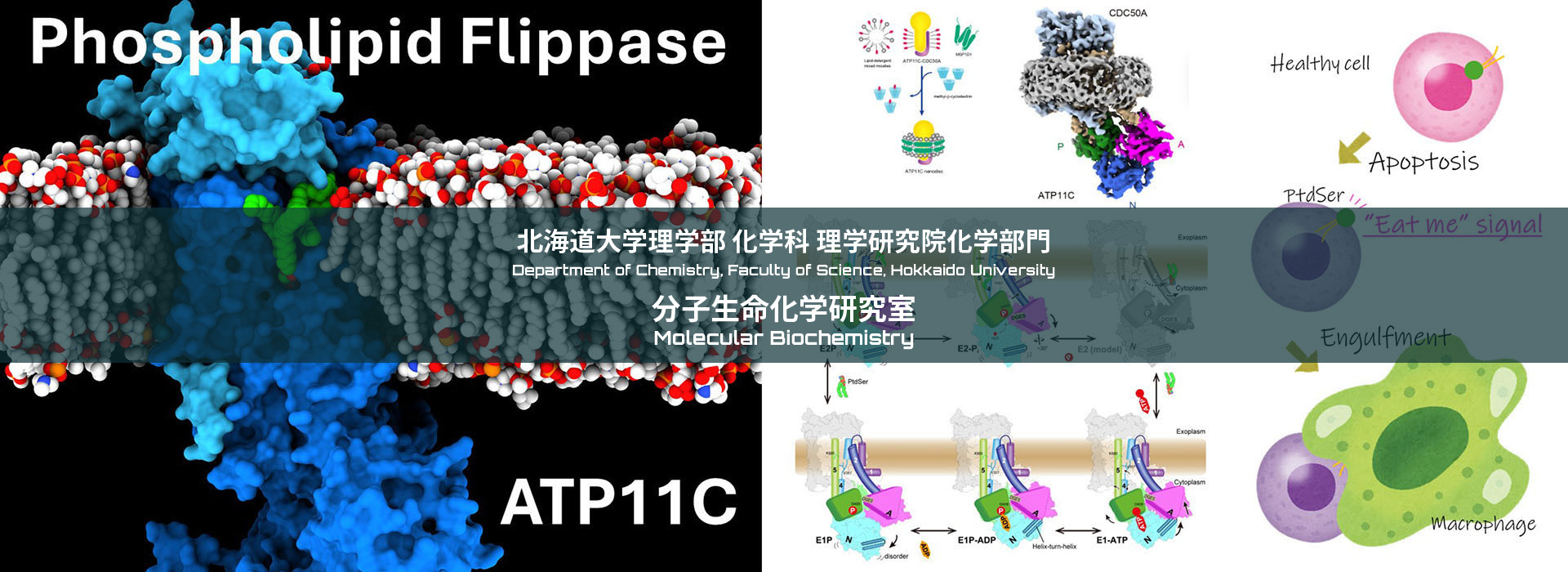
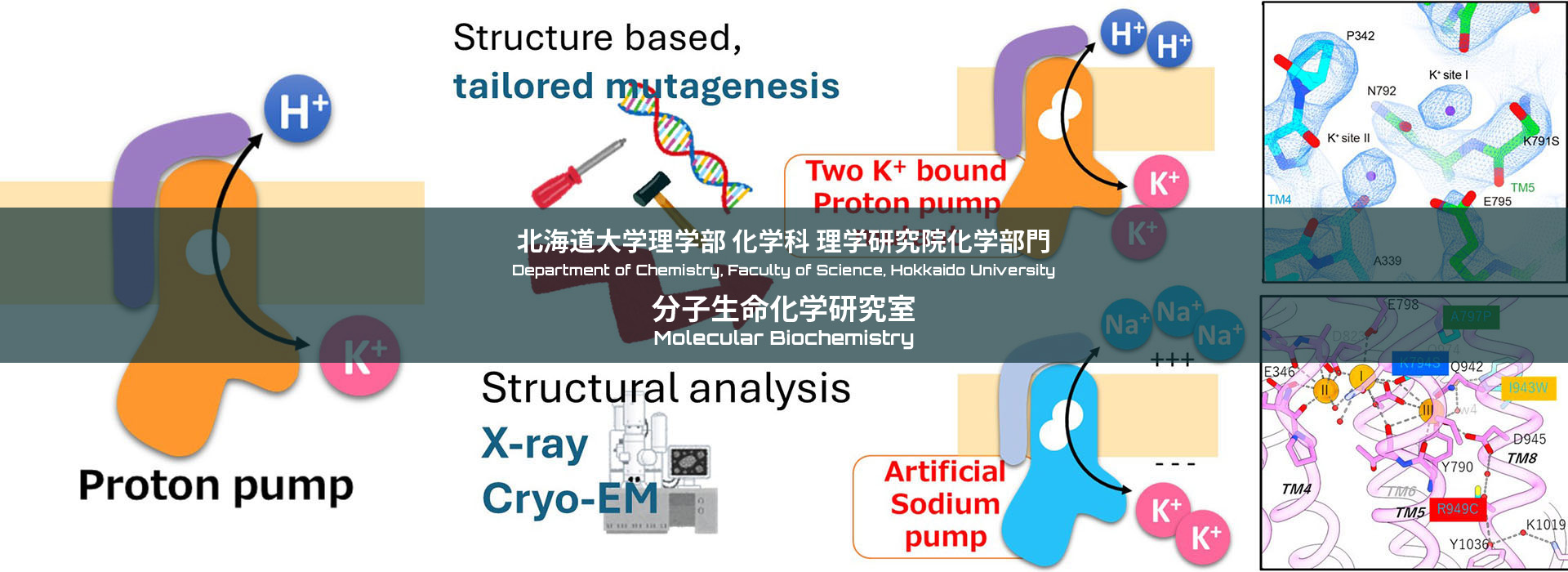
第1回分子生命化学セミナーを開催。講師は東京大学定量研の金井博士です。
第1回分子生命化学セミナー
June 12th, 2024 16:00-18:00@7-2-12 Meeting room, Science bldg. #7
東京大学定量研究所膜蛋白質解析研究分野 特任講師
金井隆太 博士
Na+,K+-ATPaseのNa+選択的性と細胞質側ゲート閉鎖の構造的理解
Na+,K+-ATPaseはATP 1分子あたり3個のNa+を細胞外へ、2個のK+を細胞内へ能動輸送し、細胞内外でのイオン濃度差を形成する。この能動輸送のためにはNa+やK+に対する親和性の変化のほか、細胞内側、細胞外側に備わる2つのゲートの開閉が必須であり、これらの状態変化はATP加水分解反応と精緻にカップリングしている。我々はその実体を原子レベルで理解することを目指して、Na+,K+-ATPaseの様々な中間状態のX線結晶構造解析およびクライオ電顕単粒子解析を進めている。2013年に世界に先駆けてNa+を結合し、閉塞した状態(E1~P·ADP·3Na+)の結晶構造を報告し、Na+選択的結合の仕組みを説明した。しかし、そこでは3個のNa+のうち、2個は高親和性な構造には見えないなど、いくつかの疑問が残った。そこで、我々はこれらの疑問に答えるべく、新たなNa+結合状態(E1·3Na+)の結晶構造を得たほか、その結晶を利用してNa+結合前に相当するE1·Mg2+状態の構造を得た。その結果、E1·3Na+状態では細胞質側ゲートが開いており、3個のNa+高親和性な結合を確認できた。また、最初にNa+が結合するサイトIIIはE1·3Na+状態でも局所的に既に閉塞状態であるのに対し、E1·Mg2+状態ではサイトIIIは当然ながら開かれており、その開閉はNa+結合に重要な、M6のほどけたループ領域が制御していることが分かった。本セミナーではこのようなNa+,K+-ATPaseのNa+選択的結合と細胞質側ゲートの閉鎖について説明する。