ヘテロクロマチンと我々の研究
生物のもつ遺伝情報はDNA上の塩基配列として記録されていて、その量は膨大です。ヒトの場合一つの細胞が持つDNAは約4メートルにもなります。この4メートルに及ぶDNAをわずか10ミクロンの核に収納しなければなりません。ですから、収納する際には、遺伝情報の読み出しや複製などの遺伝子機能を損なわないように折りたたまれていますし、逆にその折りたたみ方そのものが、遺伝子機能の制御において重要な機能を果たします。DNAの折りたたみの基本となるのがクロマチン構造で、DNAがヒストンと呼ばれる蛋白質に巻きついてそれがさらに折り畳まれ様々な構造をとります。
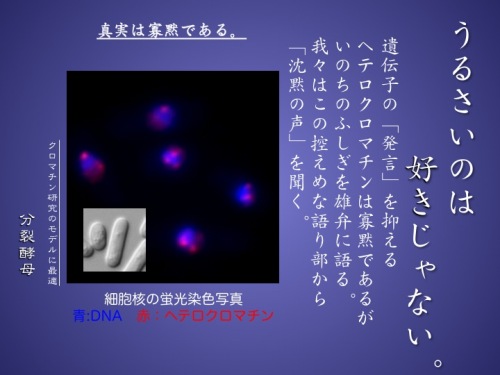
さて、種々の細胞で遺伝子発現の様子を調べると、約10%程度の遺伝子しか発現しておらず、残り90%の遺伝子は発現していません。その遺伝子の発現パターンは細胞が分化する過程で決まりますが、この決定にはDNAの塩基配列として書き込まれた遺伝情報の変化はともないません。しかし、一度決まった遺伝子発現のパターンは細胞分裂を経ても極めて安定に維持されます。このように遺伝子の変化を伴わず「安定な」遺伝子発現の調節を行う仕組みを「エピジェネティクス」と呼びます。エピジェネティクスは細胞の分化だけでなく、がん化や老化に関わり、今話題のiPS細胞の作成を初めとする再生医療においても重要な意味があります。そして、そのエピジェネティックな遺伝子発現制御に直接かかわるのがクロマチン高次構造なのです。私たちが研究対象としているヘテロクロマチンというクロマチン構造は先述のエピジェネティックな遺伝子発現抑制に関わるだけでなく、遺伝子情報の維持にも深く関わる、重要かつ複雑なクロマチン構造です。
ある生物現象を研究するとき重要なのは、その研究に適した生物をモデル系として選ぶことです。私たちは、高等真核細胞に良く似つつも単純なクロマチン構造をもつ「分裂酵母」をモデルとして選んでいます。分裂酵母は容易に突然変異体を得ることができます。ヘテロクロマチンに異常を示す沢山の分裂酵母突然変異株を単離することで、ヘテロクロマチンの形成や機能に関わる沢山の遺伝子を見つけています。それぞれの因子がいつ、どこで、どのように働くか、相互にはどのような関係があるのかを、それぞれの蛋白質の生化学的機能解析、変異株でのヘテロクロマチン構造変化の分子生物学的解析、各因子の細胞内の局在の顕微鏡による解析、などなど様々な方法をもちいて、精力的に解析しています。
エピジェネティクスの分野やヘテロクロマチン研究は先述のようにがんや老化、再生医療などに深く関わるだけに、現在多くの研究者の注目を集め競争の激しいホットな研究分野になっています。しかし、対象は複雑で研究はまだその端緒についたところにすぎません。その中で私たちは独自の成果を上げてきたと自負しています。しかし、単に競争に勝つことが目的ではなく、あくまでも自分たちの好奇心をベースに少しでも生命の神秘に迫ることを目指し、日夜研究に励んでいます。
| 【原著論文】 【英文総説】 【著書】 【和文総説】 【翻訳】 |
|
|
|
Tandemly repeated genes promote RNAi-mediated heterochromatin formation via an antisilencing factor, Epe1, in fission yeast |
|
Genes & Development 20 December 2022. 36: 1145-1159 |
|
(PMID: 36617881) |
|
|
|
The chromatin remodeler RSC prevents ectopic CENP-A propagation into pericentromeric heterochromatin at the chromatin boundary |
|
Nucleic Acids Research, Volume 50, Issue 19, 28 October 2022 |
|
(PMID:36200823) |
|
Yu H, Taniguchi M, Uesaka K, Wiseschart A, Pootanakit K, Nishitani Y, Murakami Y, Ishimori K, Miyazaki K, Kitahara K. |
|
Complete Genome Sequence of Staphylococcus arlettae Strain P2, Isolated from a Laboratory Environment. |
|
Microbiol Resour Announc. 2019 Nov 7;8(45) |
|
(PMID:31699754) |
|
Sorida M., Hirauchi T., Ishizaki H., Kaito W., Shimada A., Mori C., Chikashige Y., Hiraoka Y., Suzuki Y., Ohkawa Y., Kato H., Takahata S., Murakami Y. |
|
Regulation of ectopic heterochromatin-mediated epigenetic diversification by the JmjC family protein Epe1. |
|
PLoS Genet. 15, e1008129 (2019) |
|
(PMID:31206516) |
|
Kajitani T., Kato H., Chikashige Y., Tsutsumi C., Hiraoka Y., Kimura H., Ohkawa Y., Obuse C., Hermand D., Murakami Y. |
|
Ser7 of RNAPII-CTD facilitates heterochromatin formation by linking ncRNA to RNAi. |
|
Proc. Natl. Acad. Sci. U S A. 114, E11208-17 (2017) |
|
(PMID:29237752) |
|
Suzuki S., Murakami Y., and Takahata S. |
|
H3K36 methylation state and associated silencing mechanisms. |
|
Transcription. 1, 26-31(2017) |
|
(PMID:27723431) |
|
Tange Y., Chikashige Y., Takahata S., Kawakami K., Higashi M., Mori C., Kojidani T., Hirano Y., Asakawa H., Murakami Y., Hraguchi T., and Hiraoka Y. |
|
Inner nuclear membrane protein Lem2 augments heterochromatin formation in response to nutritional conditions. |
|
Genes to Cells. 8, 812-32(2016) |
|
(PMID:27334362) |
|
Suzuki S., Kato H., Suzuki Y., Chikashige Y., Hiraoka Y., Kimura H., Nagao K., Obuse C., Takahata S., and Murakami Y. |
|
Histone H3K36 trimethylation is essential for multiple silencingmechanisms in fission yeast. |
|
Nuc. Acid. Res. 44, 4147-62(2016) |
|
(PMID:26792892) |
|
Suzuki S., Nagao K., Obuse C., Murakami Y., and Takahata S. |
|
A novel method for purification of the endogenously expressed fission yeast Set2 complex. |
|
Protein Expr. Purif. 97, 44-49(2014) |
|
(PMID:24583182) |
|
Kato H., Okazaki K., Iida T., Nakayama J., Murakami Y., and Urano T. |
|
Spt6 prevents transcription-coupled loss of posttranslationally modified histone H3. |
|
Sci. Rep. 2186(2013) |
|
(PMID:23851719) |
|
Oya, E., Kato, H., Chikashisge, Y., Tsutsumi, C., Hiraoka, Y. and Murakami, Y. |
|
Mediator Directs Co-transcriptional Heterochromatin Assembly by RNA Interference-Dependent and -Independent Pathways. |
|
Plos Genet. 9, e1003677 (2013) |
|
(PMID:23966866) |
|
Kawakami, K., Hayashi, A., Nakayama, J-I. and Murakami, Y. |
|
A novel RNAi protein, Dsh1, assembles RNAi machinery on chromatin to amplify heterochromatic siRNA. |
|
Genes & Dev. 26, 1811-1824 (2012) |
|
(PMID:22895252) |
|
Hayashi A., Ishida M., Kawaguchi R., Urano T., Murakami Y. and Nakayama J-I. |
|
Heterochromatin protein 1 homologue Swi6 acts in concert with Ers1 to regulate RNAi-directed heterochromatin assembly. |
|
Proc. Natl. Acad. Sci. USA 109, 6159-6164 (2012) |
|
(PMID:22474355) |
|
Nakama, M., Kawakami, K., Kajitaini, T., Urano, T. and Murakami, Y |
|
DNA-RNA hybrid formation mediates RNAi-directed heterochromatin formation. |
|
Genes to Cells 17, 218-233 (2012) |
|
(PMID:22280061) |
|
Shimada A., Dohke K., Sadaie M., Shinmyozu, K., Nakayama, J-I., Urano, T. and Murakami, Y. |
|
Phosphorylation of Swi6/HP1 regulates transcriptional gene silencing at heterochromatin. |
|
Genes & Dev. 23, 18-23 (2009) |
|
(PMID:19136623) |
|
Dohke K., S. Miyazaki, Tanaka, K., Urano, T., Grewal, S. and Murakami, Y. |
|
Fission yeast chromatin assembly factor 1 assists in the replication-coupled maintenance of heterochromatin. |
|
Genes to Cells 13, 1027-43 (2008) |
|
(PMID:18761674) |
|
Kato H., Matsunaga, F., Miyazaki S., Yin, L., D'Urso, G, Tanaka, K., and Murakami, Y. |
|
Schizosaccharomyces pombe Orc5 plays multiple roles in the maintenance of genome stability throughout the cell cycle. |
|
Cell Cycle 7, 1083-1094 (2008) |
|
(PMID:18414064) |
|
Yokoyama, M., Inoue H., Ishii, C., and Murakami Y. |
|
The novel gene mus7+ is involved in the repair of replication-associated DNA damage in fission yeast. |
|
DNA repair 6, 770-780 (2007) |
|
(PMID:17307401) |
|
Locovei, A., Spiga M.-G., Tanaka T., Murakami, Y. and D'Urso, G. |
|
The Cenp-B homolog, Abp1, interacts with the initiation protein Cdc23 and is required for efficient DNA replication in fission yeast. |
|
Cell division 1, 27 (2007) |
|
(PMID:17112379) |
|
Kohzaki H. and Murakami Y. |
|
Faster and easier chromatin immunoprecipitation assay with high sensitivity. |
|
Proteomics 4, 10-14 (2007) |
|
(PMID:17152093) |
|
Murakami, Y., Chen, L.-F., Sanechika, N., Kohzaki, H. and Ito, Y. |
|
Transscription factor, Runx1 recruits the polyomavirus replication origin to replication factories. |
|
J. Cell. Biochem. 100, 1313-1323 (2007) |
|
(PMID:17063494) |
|
Kato, H., Goto, D. B., Martienssen, R. A., Urano, T., Furukawa, K. and Murakami, Y. |
|
RNA polymerase II is required for RNAi-dependent heterochromatin formation. |
|
Science 309, 467-469 (2005) |
|
(PMID:15947136) |
|
3. Ueno, M., Murase, T., Kibe, T., Ohashi, N., Tomita, T., Murakami, Y., Uritani, M., Ushimaru, T. and Harata, M. |
|
Fission yeast Arp6 is required for telomere silenging but functions independently of Swi6. |
|
Nuc. Acid. Res. 32, 736-741 (2004) |
|
(PMID:14757838) |
|
Nakagawa H., Lee J-K. Hurwitz, J. Allshire, R. C., Nakayama J-I., Grewal S., Tanaka K. and Murakami Y. |
|
Fission yeast CENP-B homologs nucleate centromeric heterochromatin by promoting heterochromatin specific histone tail modifications. |
|
Genes & Dev. 16, 1766-1778 (2002) |
|
(PMID:12130537) |
| Y. Murakami |
| Histone deacetylases govern heterochromatin in every phase. |
| EMBO J. 32, 2301-2303 (2013) |
| (PMID:23832177) |
| Shimada A. and Murakami Y. |
| Dynamic regulation of heterochromatin function via phosphorylation of HP1-family proteins. |
| Epigenetics, 530-33 (2010) |
| (PMID:20083904) |
| Kohzaki, H. and Y. Murakami |
| Transcription factors and DNA replication origin selection. |
| Bioessays 27 1107-1116 (2005) |
| (PMID:16237674) |
| Murakami Y. "Heterochromatin and Euchromatin" Springer社 "Encyclopedia of System Biology" (2013) 2100p (共著) |
| 村上洋太 「RNAiとエピジェネティクス制御」 化学同人刊『エピジェネティクス』 田嶋正二編 第6章 (2013) |
| 高畑信也、村上洋太 「ヘテロクロマチン:その形成機構と機能制御 実験医学 28, 60-67 (2010) |
| 村上洋太 「ダイナミックなクロマチン高次構造としてのヘテロクロマチン」 蛋白質・核酸・酵素 増刊号『染色体サイクル』 54, 488-495 (2009) |
| 村上洋太 「RNAiを介したヘテロクロマチンの形成機構 南山社刊「転写制御の分子機構」 加藤茂明編 第6章 (2008) |
| 村上洋太 「核内の場を介したDNA複製の制御」 羊土社刊「ゲノム複製とその制御」松影昭夫、正井久雄 編 第3章 (2002) |
| 村上洋太 「ダイナミックなクロマチン高次構造としてのヘテロクロマチン」 蛋白質・核酸・酵素 増刊号『染色体サイクル』 54, 488-495 (2009) |
| 村上洋太 「クロマチン高次構造とRNA」 細胞 『特集RNA研究の新展開』 39, 20-23 (2007) |
| 村上洋太 「ヘテロクロマチンの形成機構」 細胞工学 25, 472-476 (2006) |
| 村上洋太 「RNA干渉とヘテロクロマチン」 総研大ジャーナル 9, 225 (2006) |
| 村上洋太 「RNAiに依存するヘテロクロマチン構築におけるRNAポリメラーゼIIの役割」 蛋白質・核酸・酵素 50, 54-60 (2005) |
| 加藤太陽、村上洋太 「RNAポリメラーゼⅡとRNAi依存的ヘテロクロマチン」 実験医学 23, 2469-2471 (2005) |
| 加藤太陽、村上洋太 「ヘテロクロマチンとセントロメア」 蛋白質・核酸・酵素 49, 1990-1997 高橋孝太 編 (2004) |
| 村上洋太 「核内の場を介したDNA複製の制御」 羊土社刊「ゲノム複製とその制御」松影昭夫、正井久雄 編 第3章 (2002) |
| 村上洋太 「エピジェネティクス研究におけるモデル生物としての菌類:分裂酵母とアカパンカビ」 培風館「エピジェネティクス」David Alice, Thomas Jenuwein, Danny Reinberg編、堀越正美 監訳 第6章 (2010) |



