ホーム > 研究概要・研究内容
研究概要・研究内容
研究概要
生体中で重要な働きを担う蛋白質のしくみを解き明かすため、蛋白質の構造に基づく機能解析に取り組み、さらにそこで得られた情報をもとに蛋白質の機能設計の試みまでを強力に推し進めています。そのため、分子生物学的、生化学的手法を駆使したアミノ酸置換蛋白質の効率的な発現、精製手法から、理学部では最高性能の600 MHz超高感度高分解能NMR装置、蛋白質のミクロ構造を鋭敏にとらえるレーザーラマン分光装置、物理化学の基本原理に基づくシミュレーション計算といった物理化学的な手法まで、学際領域の多くの最新鋭の手法を取り入れて研究を進めています。このような研究で得られた成果や開発した手法は、ポストゲノムの時代に注目されている蛋白質の分子構造に基づく創薬や治療法の開発、クリーンな機能性材料としての人工蛋白質の設計など、これからの実際に社会に役立つ新技術、新材料の基礎研究としても重要な意義があります。研究内容
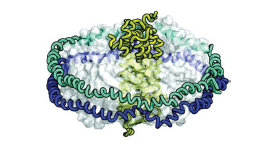
センサータンパク質の構造および機能の解析
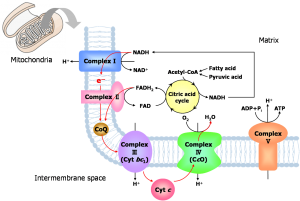
呼吸鎖における電子伝達機構の解明
「ナノディスク」を用いた膜タンパク質の構造・機能に関する研究
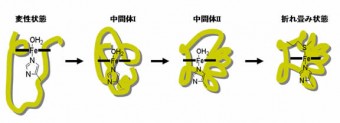
蛋白質の立体構造構築原理に関する研究
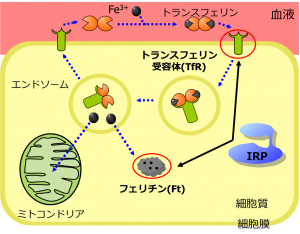
病原菌の金属イオン獲得機構
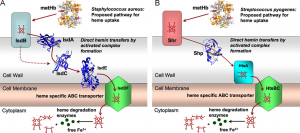 |
病原菌は増殖するために様々な金属イオンを必要とし、その多くを宿主から獲得する。例えば、鉄イオンは血液中のヘモグロビンから補酵素であるヘムを抜き取り、それを分解することで獲得している。そのため、金属イオンの獲得機構を理解することは、病原菌からの防御・医薬に関連すると考えられる。独自に開発した分光装置を利用し、病原菌の金属イオンの獲得機構を明らかにする研究を行っている。 |