癌抑制タンパク質p53:多量体形成の構造進化か
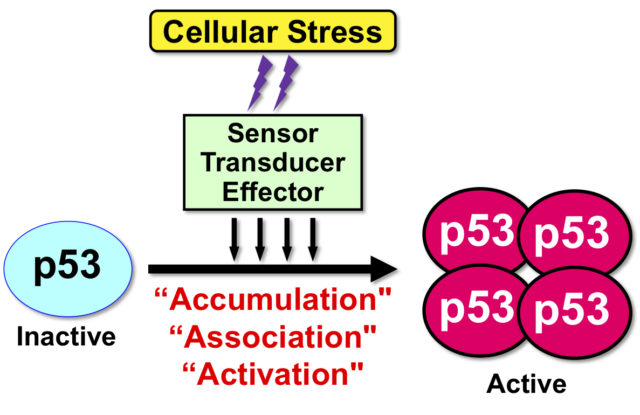
“癌抑制タンパク質p53”は、細胞がん化を防ぐメカニズムにおいて中心的役割を果たしています。そのため、p53の遺伝子TP53は悪性腫瘍において最も高頻度で変異が見つかります。また、遺伝子に障害を与える遺伝毒性ストレスばかりでなく、p53は酸化ストレス・ウイルス感染・飢餓ストレスを含む多種多様な細胞危機に応答することが見出されています。すなわち、p53が個体や組織におけるゲノムのIntegrity(完全性)を維持するために最も重要なタンパク質であると言えます。
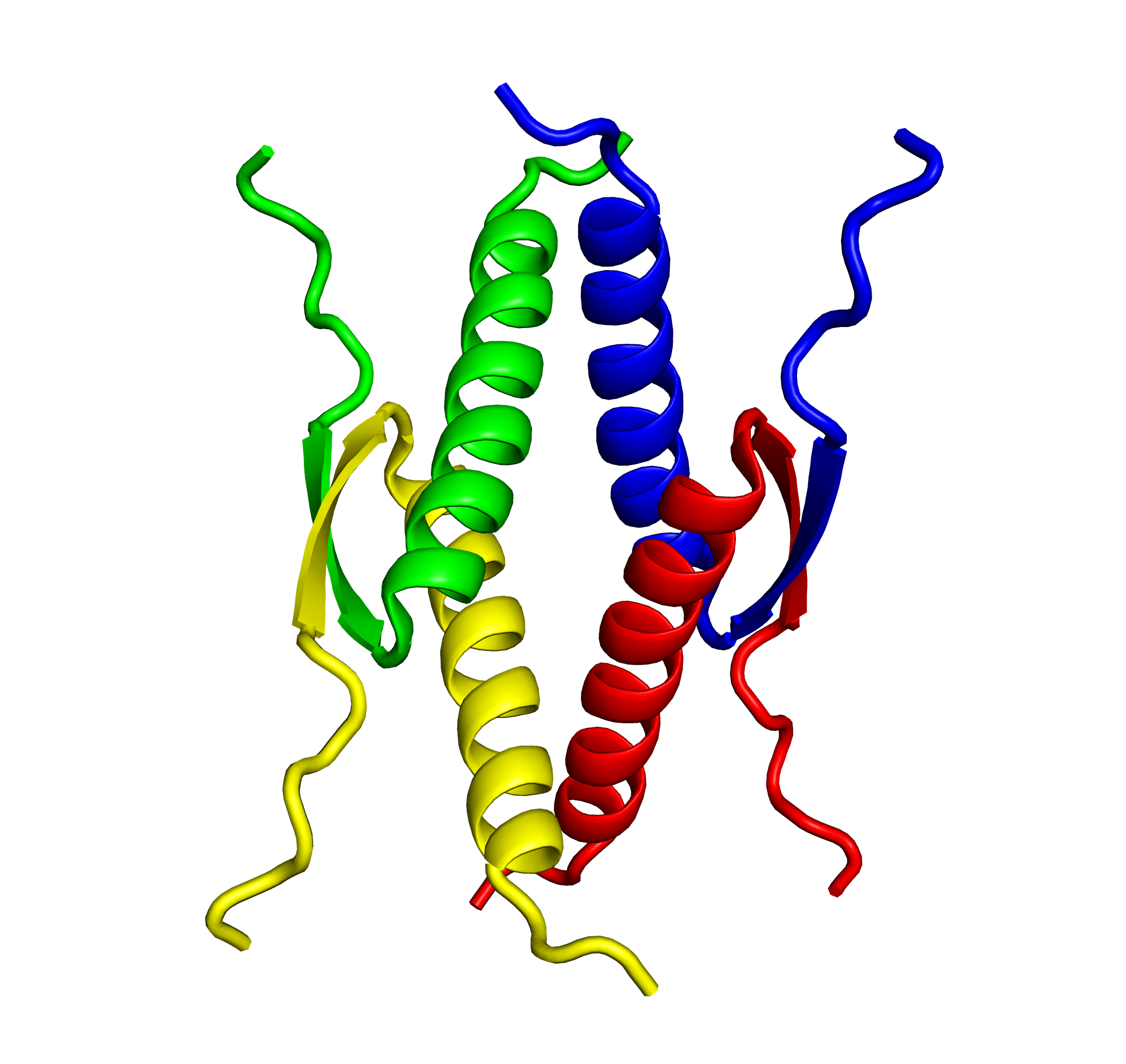
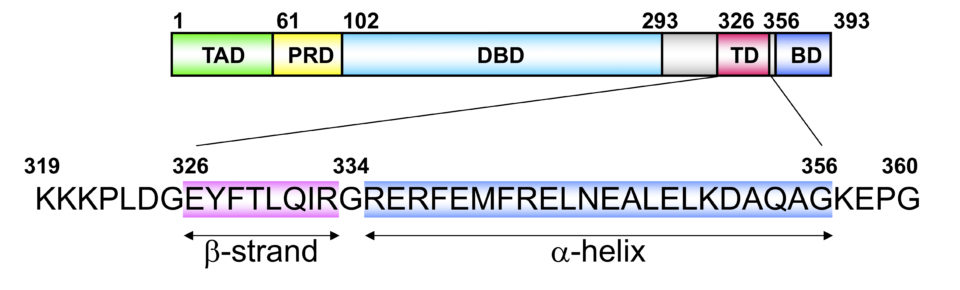
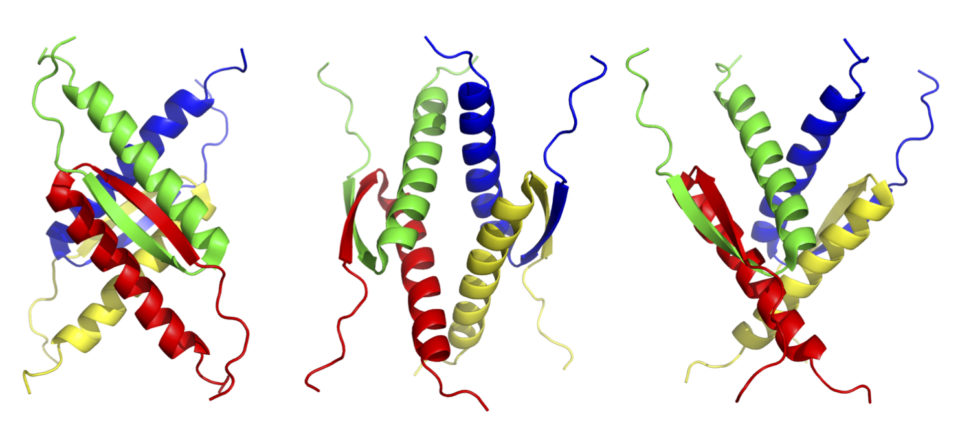
これらp53機能には、四量体の形成が必須です。p53四量体形成ドメイン(326-356位)は、C末端領域に位置しておりβストランド(326-333位)、ターン(334位)、αへリックス(335-356位)構造をとり、2つの二量体が逆平行βシートおよび4へリックスバンドルを介してユニークな四量体を形成しています。さらにp53機能は、リン酸化やアセチル化などの各種の翻訳後修飾による他のタンパク質との相互作用・多量体形成・安定性・局在の調節によって精密に制御されています。
当研究室では、p53機能発現に必須である四量体形成研究を基軸にして、生物物理学的研究から機能解明研究、進化研究、さらにはこの生命原理を用いたバイオテクノロジーへの応用まで、総括的・網羅的に研究を進めています。特に、p53制御機構の解明、脊椎動物におけるp53ファミリーの四量体進化の意義の解明、およびバイオ関連機能性分子の開発を実施しています。
私たちは、四量体形成ドメインの熱力学的安定性および多量体化の解析により、悪性腫瘍において数多く報告されている四量体形成ドメイン中の変異やアミノ酸残基の酸化が四量体構造の安定性を低下させ、p53機能不全を引き起こすことを明らかとしました。私たちは、不安定化した変異型四量体構造を安定化させる薬剤や非天然型のアミノ酸を導入した超安定型アナローグの開発に成功しています。
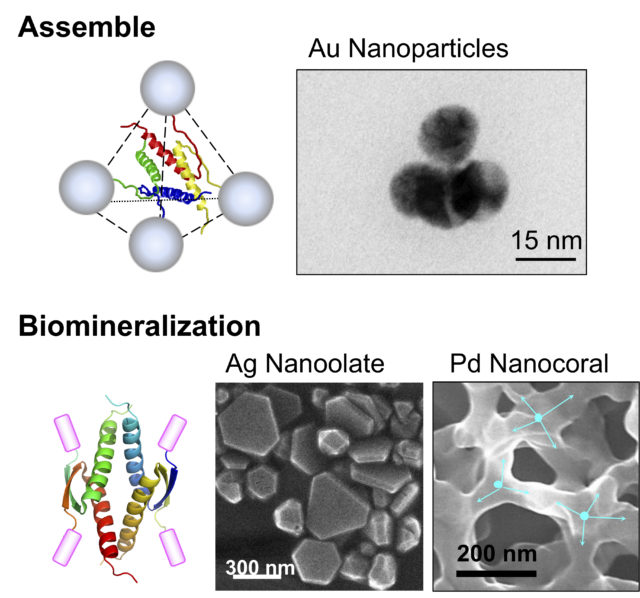
一方で、iPS細胞の樹立やゲノム編集においては、p53活性がそれらを阻害することが知られています。これらを解決するために、p53の四量体形成制御を介した細胞内p53機能を一過的に停止する手法の開発も実施しています。また、p53四量体ドメインのユニークな構造は、各種機能分子を特異的な三次元空間に配置する分子素子として使用することが可能です。この分子素子を用いて、バイオミネラリゼーションなどの生物活性を高機能化できることを示しています。
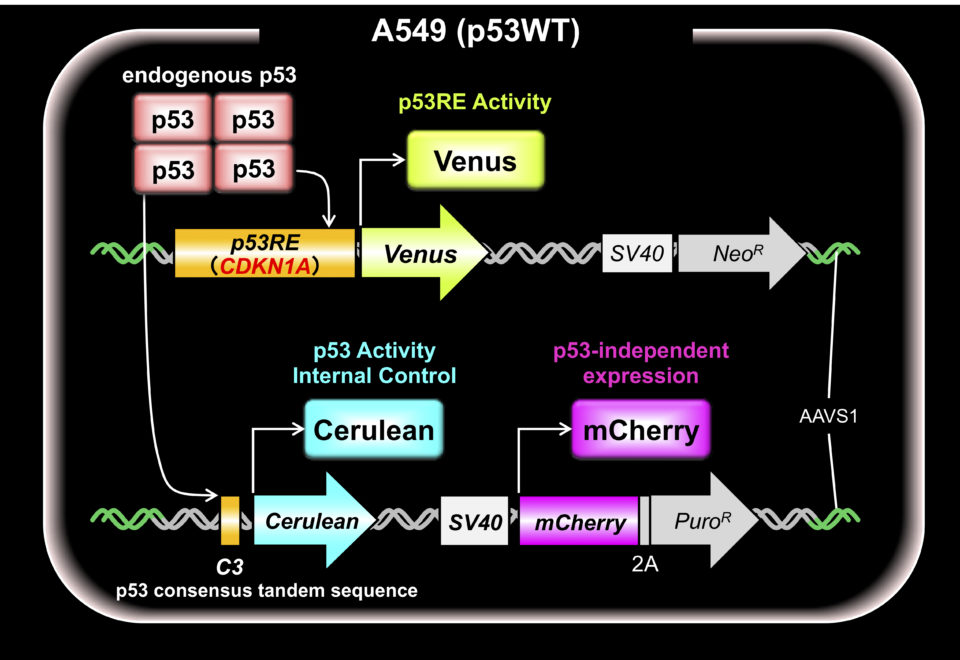
さらに、“生細胞”の“生理的濃度”において“定量的”にモニターすることは、細胞内でのp53機能を理解するうえで、極めて困難かつ重要です。そこで私たちは、蛍光タンパク質を用いた解析系を開発しています。これを用いて、p53四量体形成量、初期の癌細胞における正常型と変異型とのヘテロ四量体形成、ドミナントネガティブ効果および下流標的遺伝子への選択性に関する知見を得ることが可能になります。