生命科学における生物化学のもっとも重要なテーマのひとつは、『”化学反応”の集積がいかにして”生命”となりうるか』の解明にあり、この鍵となるものが、『極めて多様なタンパク質の特異的な相互作用と認識に基づく機能の厳密な制御』です。タンパク質の多量体化と翻訳後修飾による調節は、その機能制御において最も重要なメカニズムであり、生物化学研究室では以下の4つの研究テーマについて研究をすすめ、化学的視点から生命の統合的な理解を目指しています。
癌抑制タンパク質p53:多量体形成の構造進化から細胞周期制御メカニズムの解明、そして応用へ
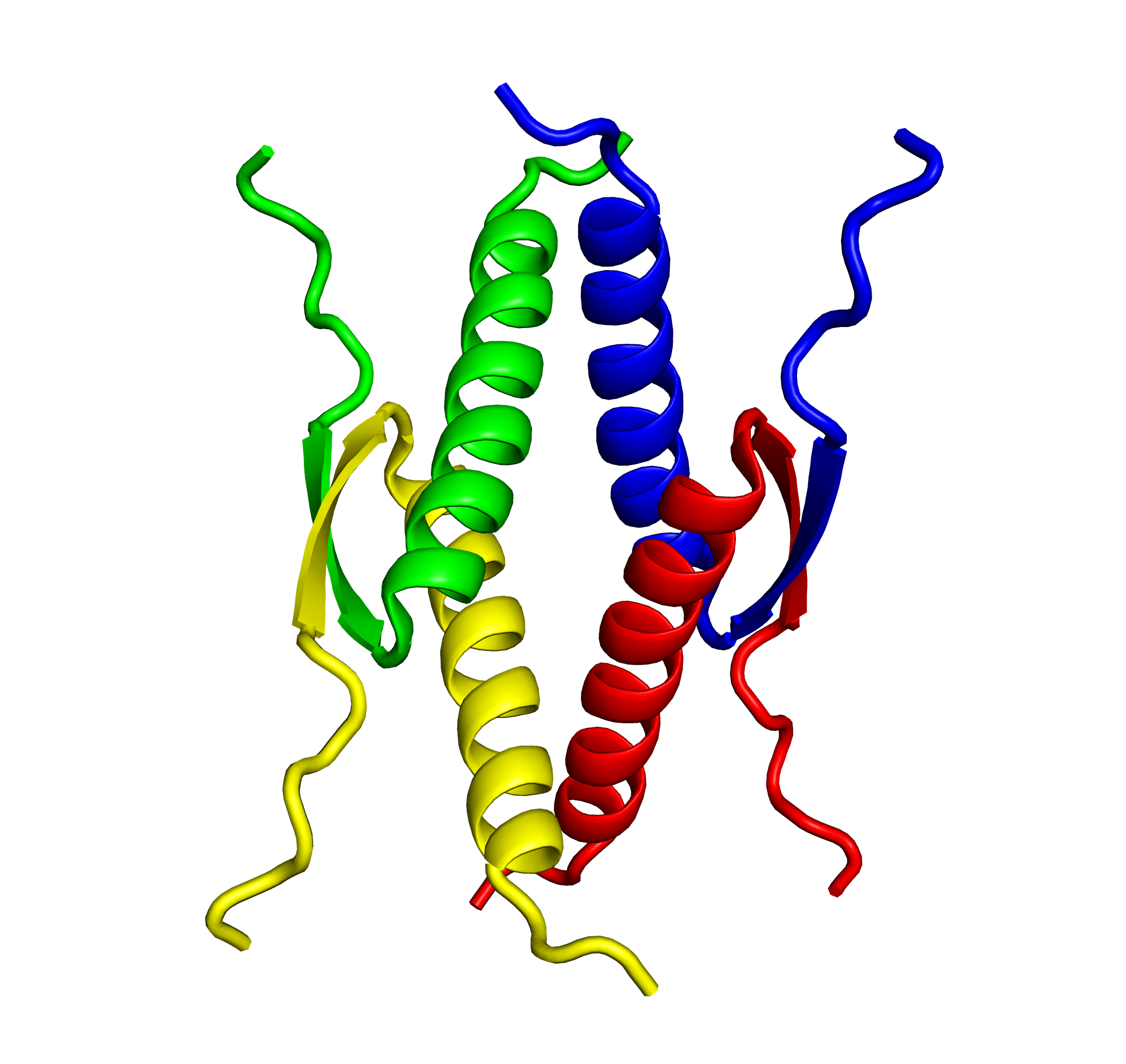
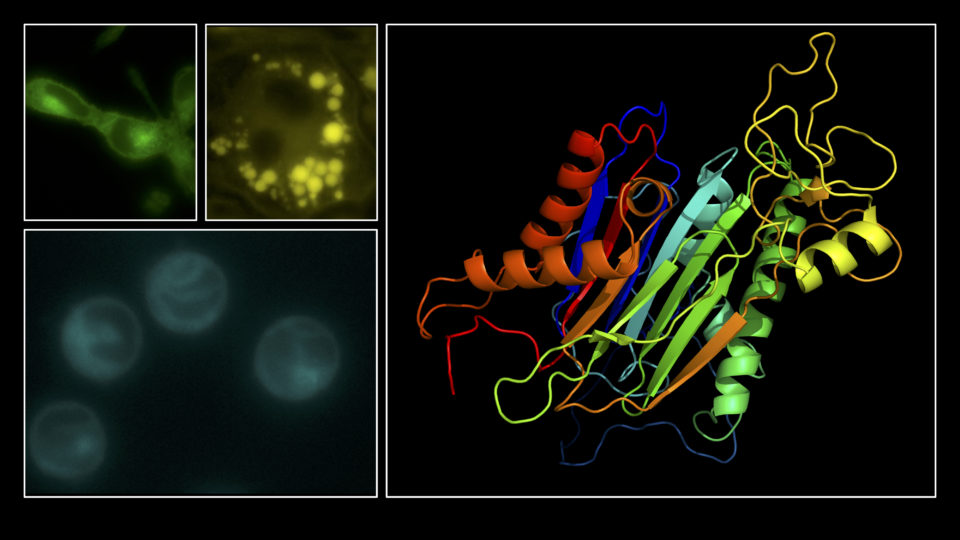
“癌抑制タンパク質p53”は、細胞がん化を防ぐメカニズムにおいて中心的役割を果たしています。p53はDNA損傷・酸化ストレス・ウイルス感染・飢餓ストレスを含む多種多様な細胞危機に応答し、個体や組織におけるゲノムのIntegrity(完全性)を維持するために最も重要なタンパク質であると言えます。これらp53機能には、四量体形成が必須です。
当研究室では、p53機能発現に必須である四量体形成研究を基軸にして、生物物理学的研究から機能解明研究、進化研究、さらにはこの生命原理を用いたバイオテクノロジーへの応用研究まで、総括的・網羅的な研究を進めています。
脱リン酸化酵素PPMファミリーの機能解明と抗がん剤開発
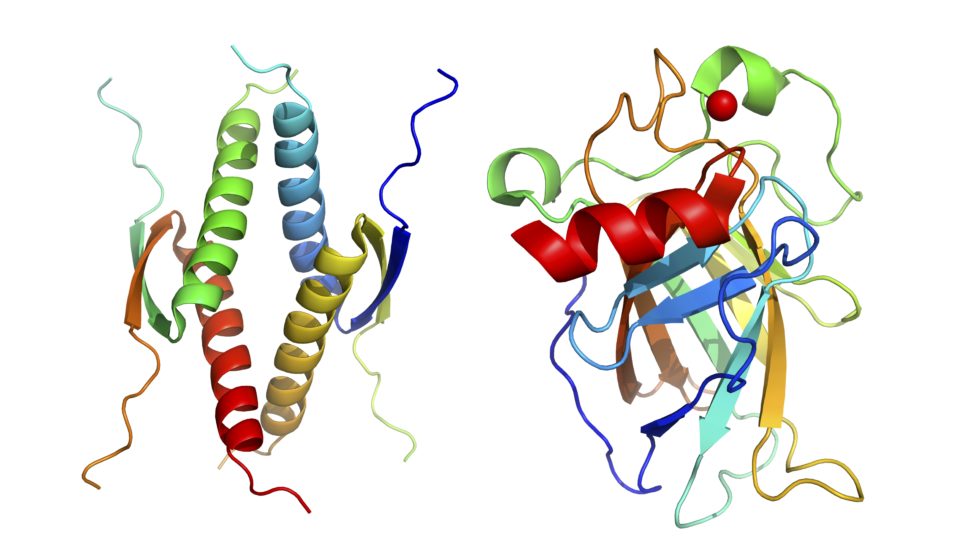
タンパク質のリン酸化・脱リン酸化は、生体内シグナル伝達の制御において最も重要なメカニズムです。脱リン酸化酵素であるストレス応答性PPMファミリーの異常は、がんを含む様々な疾患と関連しています。特に、p53誘導性ホスファターゼPPM1Dの異常は非常に多くのがんで報告されています。
当研究室では、強力で特異的な新規PPM1D阻害剤を開発しています。これらPPM1D阻害剤は、小児がんをはじめとする各種がんに高い抗がん活性を示し、PPM1Dを標的とした分子標的薬として期待されています。さらに、重要な他のPPMファミリーの新規機能や基質認識機構の解明も実施しています。この一環として、PPMファミリーにおける新規基質同定法の開発も進めています。
p53誘導性ホスファターゼPPM1Dによる自然免疫制御機構の解明〜新規がん治療法開発を目指して〜
生体には、免疫細胞によるがん細胞の排除など、細胞の「がん化」を防ぐ様々な機構が存在します。好中球は白血球のなかで50-70%を占め、自然免疫の最初期に機能して生体を守っています。好中球には機能や発現時期のことなる様々な細胞が存在し、がん組織に集積して免疫抑制的に機能する免疫抑制細胞が報告されています。p53誘導性ホスファターゼPPM1Dは、近年免疫応答や代謝に関与することが明らかとなり、細胞内における多様な機能に大きな注目が集まっています。
当研究室では、免疫抑制的に機能する腫瘍特異的好中球に着目し、p53誘導性ホスファターゼPPM1Dによる腫瘍特異的好中球への分極化および免疫応答の分子制御機構の解明を進めています。さらには、生体内の免疫応答やがんと深く関わる脂肪細胞の分化・成熟における制御機構を明らかにすることを目指しています。
生命原理の追求:セントラルドグマと鏡像型生体分子間相互作用の理解を目指して
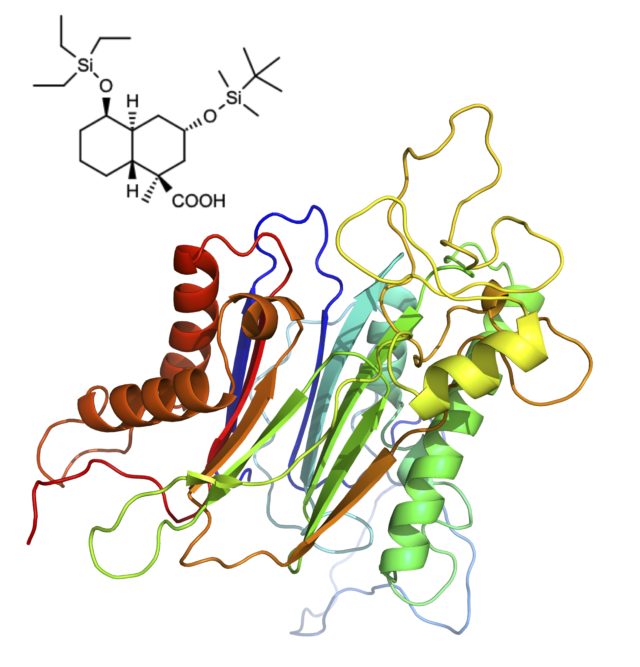
細胞では、遺伝情報がDNA複製によって保存され、DNAの情報がmRNAに転写され、mRNAの情報をもとに翻訳により生命現象を担うポリペプチド(タンパク質)が合成されます。この経路は、セントラルドグマと呼ばれ、生命原理の根幹をなすものとして扱われています。最初の生命がどのように形成され、進化してきたのかは生命科学の最も重要な目標の一つです。当研究室ではセントラルドグマの原理から外れた、細菌におけるポリペプチドの合成経路とその機能の解明というチャレンジングな研究を実施しています。
また、生命の起源において、なぜL体のアミノ酸を含むタンパク質やD体のデオキシリボースを含むDNAが選択されたかはまだ明らかとはなっていません。さらに、鏡像体分子間の認識能の交差性について実験的に解き明かすことは創薬の面からも非常に重要です。当研究室では鏡像体生体分子間の特異的相互作用の解明を目指しています。