脱リン酸化酵素PPMファミリーの機能解明と抗が
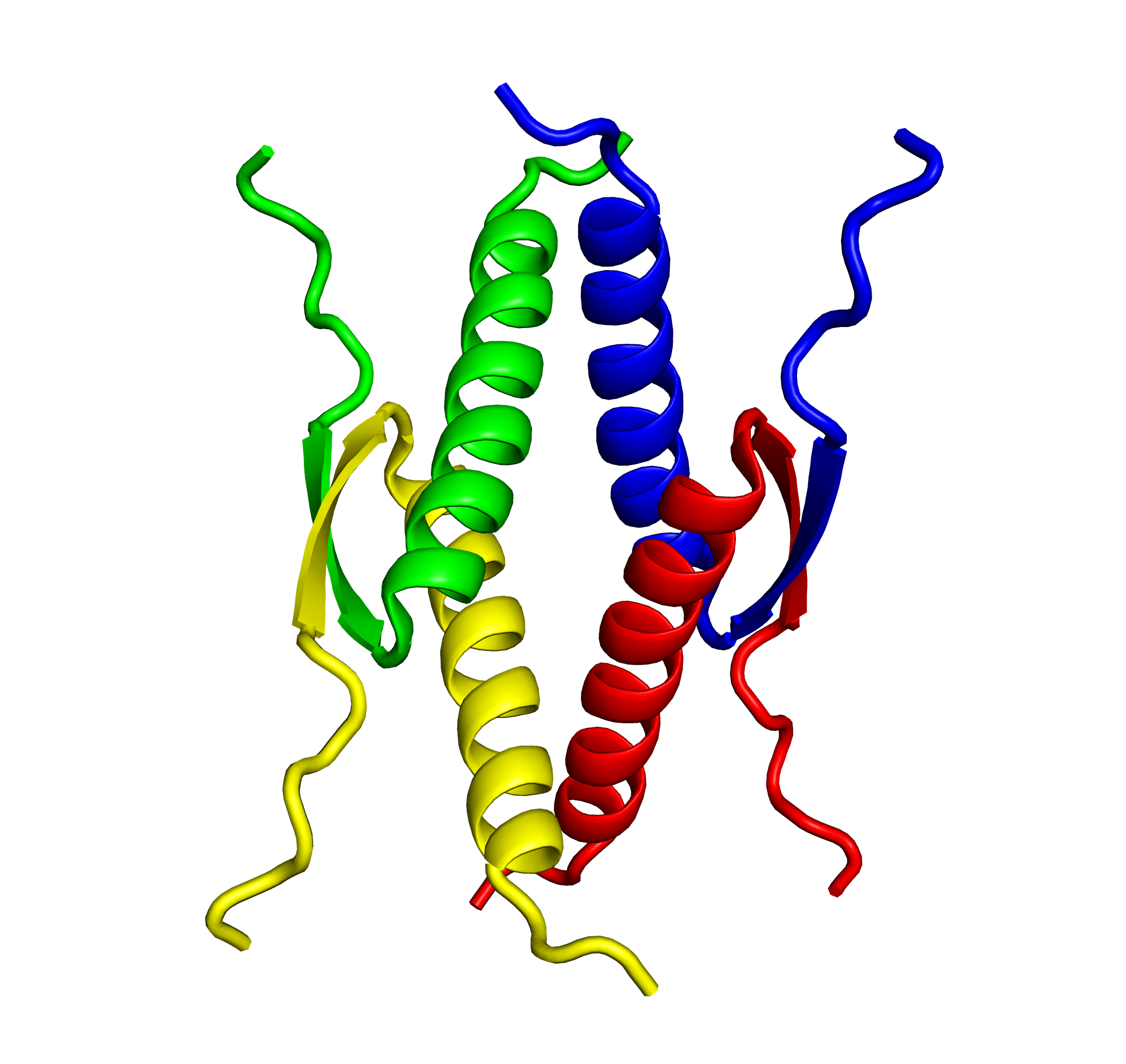
PPMファミリーは、様々なシグナル伝達経路を通じてストレス応答、アポトーシス、細胞周期等を制御していると考えられています。近年、PPMファミリーの遺伝子異常による機能不全や亢進が、癌や低血圧症などの様々な疾患に関与することが報告されています。PPM1Dが属するPPMファミリーはMn2+/Mg2+依存的ホスファターゼであり、ヒトでは20種類のアイソフォームが存在します。当研究室ではPPMホスファターゼの新規基質同定法の開発を進め、各アイソフォームの標的タンパク質の同定やアイソフォーム特異的阻害剤の開発を進めています。
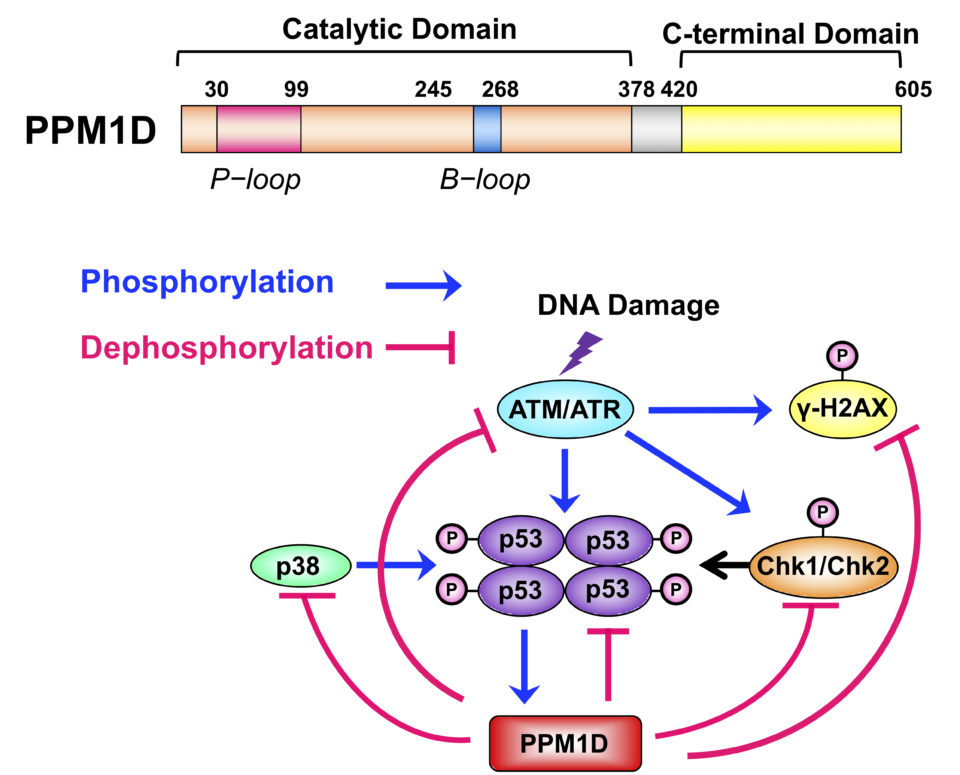
PPM1D(Protein Phosphatase Magnesium-dependent 1, Delta)は、紫外線や電磁線などによりDNA損傷に応答して癌抑制タンパク質p53を介して誘導されるPPMタイプSer/Thrホスファターゼとして発見されました。正常細胞において、PPM1DはDNAダメージに伴い活性化された細胞周期の停止やアポトーシスに関与する上流のタンパク質p53, p38, ATMなどを脱リン酸化・不活性化し、細胞周期をもとの状態に戻すネガティブフィードバック機能を有しています。一方、乳癌をはじめとする多種多様ながん細胞においてPPM1D遺伝子増幅やタンパク質レベルの上昇が見られます。また、PPM1Dノックアウトマウスが細胞癌がん化に抵抗性を持つことから、PPM1Dの過剰な活性が発癌に深く関与していると考えられています。しかしながら、PPM1D過剰発現による細胞癌化メカニズムは未知の部分が多く、このメカニズムを理解することはPPM1Dを標的とした癌治療のためにも極めて重要です。
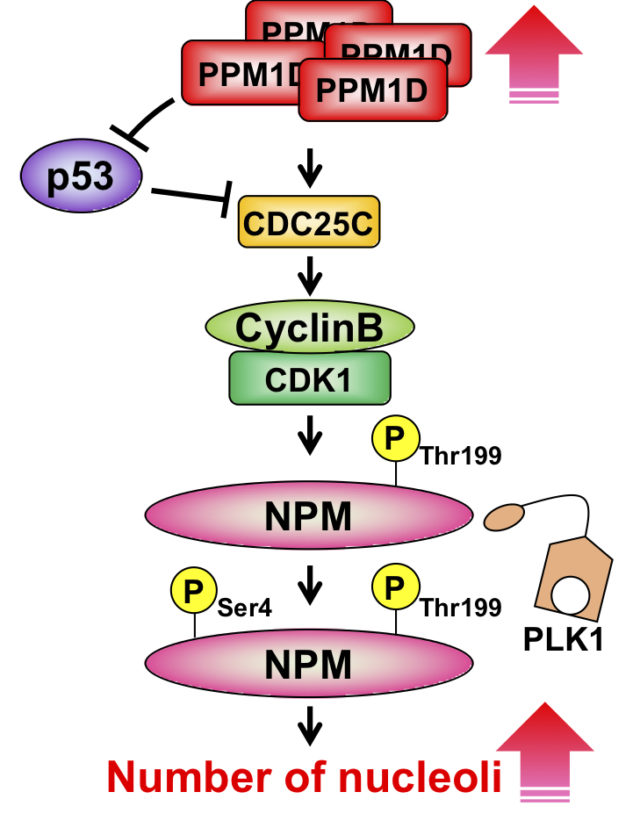
当研究室では、PPM1Dの新規結合タンパク質の同定や細胞内局在解析を介してPPM1D過剰発現による細胞癌化メカニズムの解明を行っています。これまで、PPM1Dの過剰発現により癌細胞診の指標に使われる”核小体”の数が増加することを見出しています。核小体は膜のない構造体で、Liquid-liquid phase separationの原理で形成されるリボソーム生合成の場であり、近年大きな注目を集めています。当研究室は、PPM1Dと核小体タンパク質ヌクレオフォスミンNPMに着目し、その詳細な形成メカニズムの解明を目指しています。
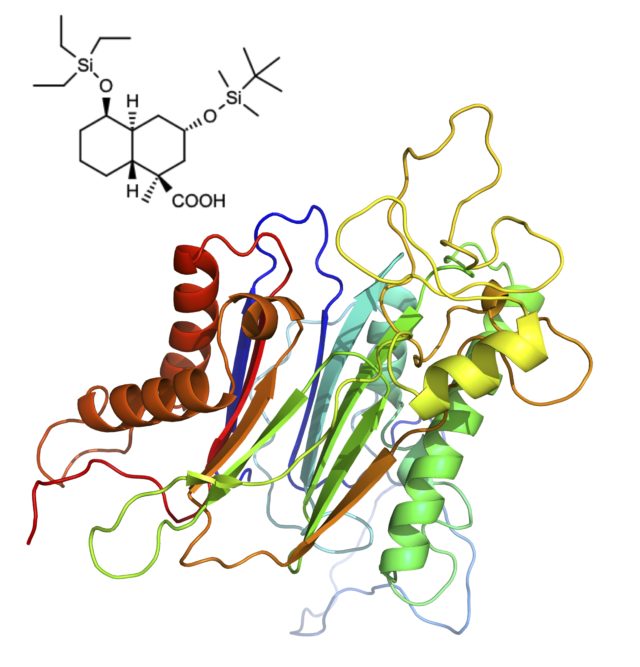
また、PPM1D阻害剤は新たな抗癌治療薬のターゲットとして期待されており、PPM1Dに対して強力で特異的な阻害活性を有する低分子”SL阻害剤”の開発に成功しています。当研究室で開発した”SL阻害剤”は、in vitroおよびin vivoで極めて効果が高いことから、PPM1Dの機能解析における強力な分子ツールとして非常に有効であるばかりでなく、PPM1Dを標的としたがんの化学療法などの分子標的薬として期待されています。
非常に多彩な機能を持つPPMホスファターゼですが、その多くは基質標的タンパク質が未知であり、研究推進のための大きな障害となっています。当研究室では、PPMホスファターゼの新規基質同定法の開発を実施しています。さらに、癌抑制タンパク質とされるILKAPをはじめとした他のアイソフォームについても、標的タンパク質の同定やアイソフォーム特異的阻害剤開発を進めています。これらをとおして、PPMファミリータンパク質の遺伝子異常と疾患メカニズムの関係の解明を目指しています。