p53誘導性ホスファターゼPPM1Dによる自然
好中球は白血球のなかで50-70%を占め、自然免疫の最初期に機能して生体を守っています。好中球には機能や発現時期のことなる様々な細胞が存在し、がん組織に集積し免疫抑制的に機能する腫瘍特異的好中球が報告されています。当研究室では、免疫抑制的に機能する腫瘍特異的好中球に着目し、p53誘導性ホスファターゼPPM1Dによる腫瘍特異的好中球への分極化および免疫応答の分子制御機構の解明を目指しています。
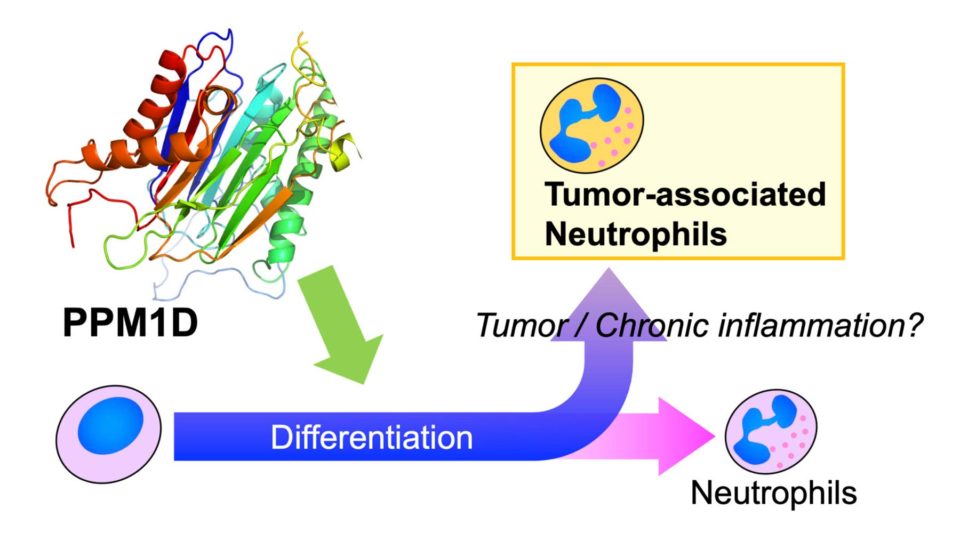
p53誘導性ホスファターゼ PPM1Dは白血病や骨髄異形成症候群において、その過剰発現や遺伝子変異が高頻度で報告されており、免疫細胞の分化・機能制御に関与すると考えられています。Ppm1dノックアウトマウスは免疫不全や精子形成異常、代謝異常を示すことが知られ、PPM1Dは発癌のみならず免疫応答、代謝においても重要な役割を果していることが示唆されています。我々の研究室では、Ser/ThrホスファターゼPPM1Dに注目し、免疫細胞の分化や免疫応答、免疫細胞とがんの関係を明らかにすることを目指しています。我々は、PPM1DのC末端領域の異なるスプライシングバリアントPPM1D430を見出しており、このバリアントが白血球と精巣に特異的に発現していることを明らかとしています。さらに、PPM1Dの阻害により好中球の分化が誘導されることを明らかにしています。我々は、PPM1DとスプライスバリアントPPM1D430が好中球においてその局在が異なることを明らかとしており、白血球特異的バリアントPPM1D430が好中球においてPPM1Dとは異なる機能制御を受けている可能性を見出しています。当研究室は、スプライシング制御および腫瘍特異的好中球に着目し、PPM1Dによる好中球の分化および機能制御について解析を進めています。
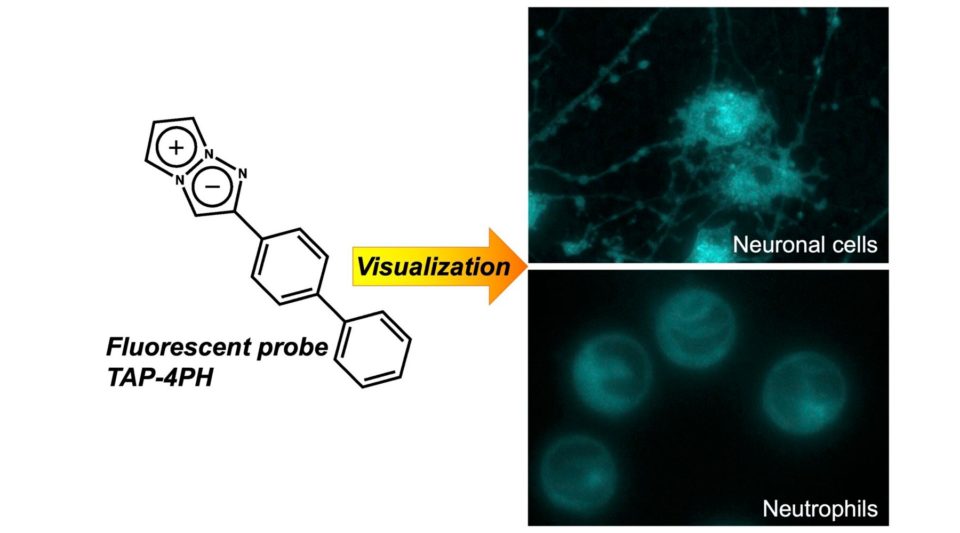
我々は、細胞分化におけるPPM1Dの機能を解析するため、蛍光プローブTriazapentalene誘導体を用いた細胞分化や刺激応答を迅速・簡便に可視化する新規手法、さらには脂肪滴を特異的に可視化する手法を開発しています。
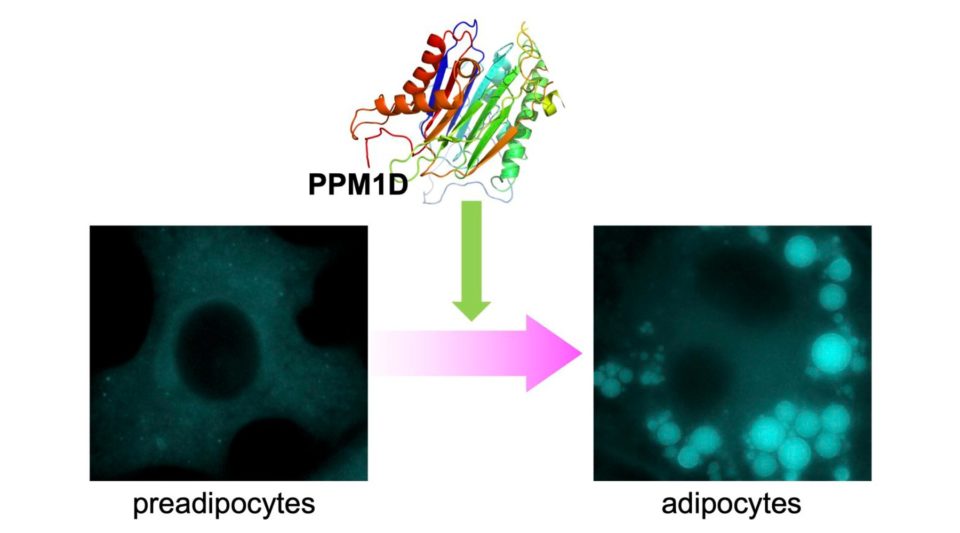
また、生体内の免疫応答と密接に関わる脂肪細胞の分化・脂肪滴形成や、破骨細胞におけるPPM1Dの機能解明も進めています。脂肪細胞にはエネルギー貯蔵を担う白色脂肪細胞、熱産生を行う褐色脂肪細胞、ベージュ脂肪細胞が存在します。白色脂肪細胞の過剰な産生と肥大化は肥満を引き起こすことから、そのメカニズム解明が強く求められています。我々はこれまでに、PPM1Dが白色脂肪細胞の分化を制御しており、PPM1D阻害剤の投与により白色脂肪細胞への分化が強力に抑制されることを見出しています。脂肪滴形成制御のメカニズム解明や、白色脂肪細胞からベージュ脂肪細胞が誘導されるベージュ化におけるPPM1Dの機能解明を進めています。
これらの研究により、新しい癌治療法の開発や、肥満治療法の開発へと展開されることが期待されます。