発表論文からpickup
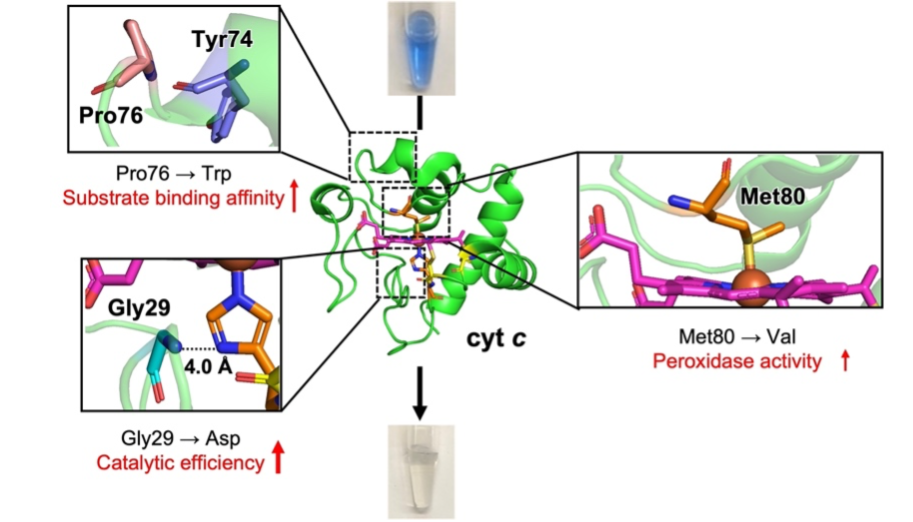
DyP型ペルオキシダーゼ(DyP)は、ヘムと過酸化水素の反応で生じたラジカルにより、難分解性のアントラキノン系色素を容易に分解する。そのため、このDyPを発現させた大腸菌による色素分解を期待したが、大腸菌内ではDyPがヘムを持たない状態で発現することが問題となっていた。そこで、生体内でヘムと共有結合を形成して発現する、電子伝達タンパク質シトクロムc (cyt c)を用い、大腸菌内で効率的に難分解性色素を分解可能な酵素の設計を試みた。DyPの構造に見られるヘム近位側の水素結合を導入し、色素分解に必須なラジカルの生成を促進するため、cyt cのGly29をAspに置換した結果、中性条件で野生型の色素分解活性の約80倍の触媒効率を示す変異体の作成に成功した。この結果はDyPを模倣した色素分解酵素の設計に新たな知見を与えるものである。
Regulation of the expression of the nickel uptake system in Vibrio cholerae by iron and heme via ferric uptake regulator (Fur), Kazuyoshi Muranishi, Koichiro Ishimori and Takeshi Uchida, J. Inorg. Biochem. 298, 11713 (2022)
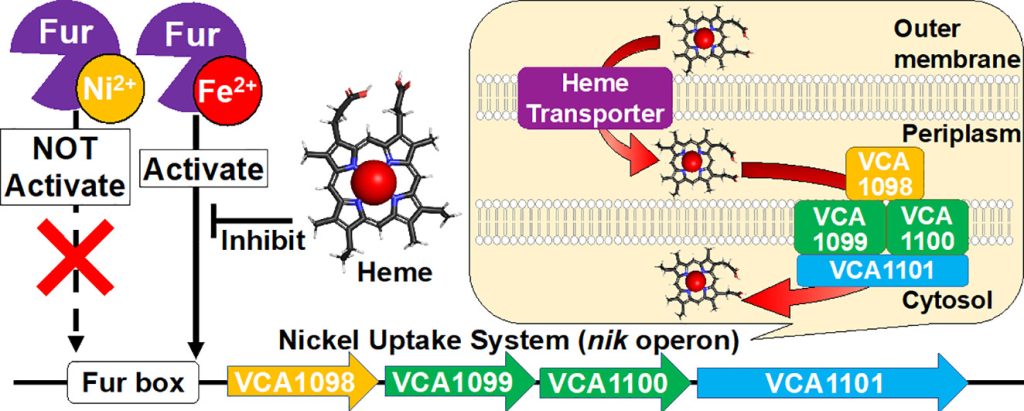
コレラ菌では、ニッケルの取り込みに関与する遺伝子”nikオペロン”の上流に、鉄応答性の転写制御因子であるFurが存在する。大腸菌などの他の生物種では、nikオペロンは細胞内のニッケルの濃度依存的に転写が調節される、コレラ菌とは異なる転写制御機構を持つ。これまでニッケルがFurによる遺伝子転写制御に関わるという報告はなかったことから、コレラ菌のnikオペロンがFurを介して、ニッケルで制御されるのか鉄で制御されるのかを検討した。
FurはFe2+の存在下でFur boxと呼ばれる特定の遺伝子配列に特異的に結合するのに対し、Ni2+存在下ではDNAとFurが非特異に結合することが明らかにした。また、細胞内の鉄のほとんどはヘムとして存在することから、ヘムによるFurのFur box結合への影響を検討したところ、ヘムはFur-Fur box複合体へのヘム添加は、Fur boxからのFurの解離を誘発することを示した。このことから、コレラ菌のnikオペロンは鉄とヘムの両方によって発現が調節されることが示された。さらに、nikオペロンタンパク質であるVCA1098は、1.3μMの解離定数でヘムに結合した。我々の結果は、nikオペロンがニッケルの取り込みだけでなくヘムの取り込みにも関与しており、細菌内の鉄とヘムの濃度に依存していることを示唆している。
Radical transfer but not heme distal residues is essential for pH dependence of dye-decolorizing activity of peroxidase from Vibrio cholerae, Takeshi Uchida, Issei Omura, Sayaka Umetsu and Koichiro Ishimori, J Inorg. Biochem., in press
色素分解型ペルオキシダーゼ(DyP)は、過酸化水素を用いてアントラキノン系色素の分解を触媒するヘム酵素である。DyPの色素分解反応にはpH依存性があり、酸性域でのみ進行するがその要因は不明であったため、コレラ菌由来DyP(VcDyP)の変異体をもちいて検討した。DyPは、ヘムと過酸化水素の反応によりラジカルが生じ、生成されたラジカルがタンパク質表面の活性部位に移動することで色素を分解する。VcDyPのヘム遠位側に位置するAsp144はラジカル生成において重要な役割を担う残基であり、このAsp144をHisに置換すると活性が失われた。このAsp144よりもヘムから離れた位置にHisを導入した変異体を作成したところ、活性は回復したが色素分解活性の至適pHは酸性域のままであったことから、Asp144は色素分解反応のpH依存性に寄与しないことが明らかとなった。そこで、シミュレーション解析によりラジカルの移動経路を探索した結果、その経路上に位置するAsp138はHis178と水素結合可能な位置に存在していた。このAsp138をValに置換し、水素結合形成できない変異体を作成したところ、色素分解活性の至適pHが中性域に移動した。以上のことから、VcDyPの色素分解反応のpH依存性には、ヘム近傍のAsp138とHis178間の水素結合が寄与していることが示唆された。
Mechanistic insights into heme-mediated transcriptional regulation via a bacterial manganese-binding iron regulator, iron response regulator (Irr), Dayeon Nam, Yuki Matsumoto, Takeshi Uchida, Mark R. O’Brian and Koichiro Ishimori, J. Biol. Chem., 295, 11316-11325 (2020) (DOI: 10.1074/jbc.RA119.011855)
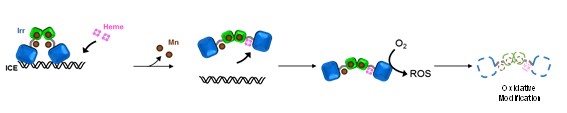
窒素固定菌(Bradyrhizobium japonicum)のヘム生合成を転写レベルで抑制的に制御する転写因子Iron Response Regulator(Irr)は、細胞内で利用できる鉄量が十分であると、ヘムの結合により酸化的修飾が誘起され、その結果、Irrそのものが分解されることで標的DNA配列であるIron Control Element(ICE)から解離し、ヘム生合成が進行すると考えられていた。しかし、今回の論文では、IrrのICEへの結合はMn2+の結合が必須であり、ヘムの結合によりMn2+が解離することによって、Irrは酸化修飾を受けることなくICEへの結合能を失うことが明らかとなった。これらの結果は、Irrにおけるヘムに依存した新たな転写制御機構を提案するとともに、細胞内での生命金属間の相互作用も示唆している。
Osmotic pressure effects identify dehydration upon cytochrome c–cytochrome c oxidase complex formation contributing to a specific electron pathway formation, Wataru Sato, Seiji Hitaoka, Takeshi Uchida, Kyoko Shinzawa-Itoh, Kazunari Yoshizawa, Shinya Yoshikawa and Koichiro Ishimori, Biochem. J., 477, Biochem J (2020) 477, 1565–1578 (2020) (DOI: 10.1042/BCJ20200023)
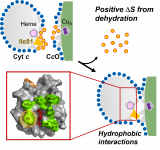
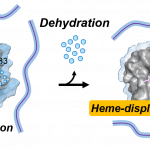
ATP合成の中枢を担うミトコンドリア電子伝達系において、ヘムタンパク質シトクロムc(Cyt c)は複合体IIIからシトクロムc酸化酵素(CcO)への電子移動を仲介する役割を有する。これらCyt c-CcO間で形成される電子伝達複合体は、近年のシミュレーション(Sato et al., J. Biol. Chem., 2016)より、従来提唱されてきた静電相互作用よりもむしろ疎水性相互作用の形成によって安定化されることが予測されていた。本研究では疎水性相互作用の形成に伴いタンパク質疎水面の水分子が放出(脱水和)されることに着目し、この脱水和過程をCyt c-CcO間電子伝達反応における浸透圧効果を通して検討することで、疎水性相互作用の複合体形成への熱力学的寄与を考察した。その結果、これらのタンパク質間で複合体を形成する際には20分子程度の水分子が脱水和しており、この脱水和に起因するエントロピーの増大が会合に伴う並進回転エントロピーの減少を補償し、複合体の安定化に寄与することが明らかとなった。さらに、変異体実験及びドッキングシミュレーションより、脱水和した水分子の約半数がCyt cのヘム近傍に位置する疎水性アミノ酸残基Ile81周辺に由来していることが新たに示された。このようなヘム近傍で形成される疎水性相互作用は酸化還元中心間への水分子の流入を防ぐという点で、Cyt c-CcO間の電子伝達経路の形成に寄与していることが推察される。
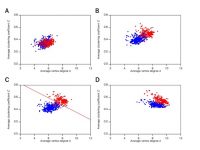
Quantitative description and classification of protein structures by a novel robust amino acid network: interaction selective network (ISN), Shohei Konno, Takao Namiki and Koichiro Ishimori, Sci. Rep., 9, 16654 (2019) (DOI: 10.1038/s41598-019-52766-6)
タンパク質は,アミノ酸が直鎖状につながったペプチドがアミノ酸残基間の相互作用により一定の構造を形成して機能しており,すべての生物の生命活動を担う重要な分子です。つまり,生命活動をミクロな目で解析するためにはタンパク質の構造を知ることが重要で,これまで多くのタンパク質の構造が解明されています。その構造は多様ですが,部分的な構造は類似している場合が多いため多くの研究者が一定の分類をできると考えてきました。しかし,その分類基準は研究者の主観に頼るところが多く,また客観的な解析が期待できるタンパク質構造の数学的解析でも分類に成功していません。このように,タンパク質構造が機能を決め,それによって生命活動を維持しているにもかかわらず,タンパク質構造を客観的な指標に基づいて分類することは困難でした。
この論文では,タンパク質を構成するアミノ酸残基を点で,結合や相互作用しているアミノ酸残基を点と点をつなぐ線として捉える新たなネットワーク理論を構築し,その理論を実際の約1,500種のタンパク質構造に対して適用しました。
その結果,特定のネットワークパラメータを用いることで立体構造の分類に成功し,数学的な客観的指標によりタンパク質全体の構造の分類が可能であることが示されました。
これにより,どのような構造がタンパク質として機能するのか,あるいは生物進化の過程でどのような構造がタンパク質として選ばれてきたのか,さらにどのような構造をもたせることによって人工的に安定で高機能なタンパク質類似物質や生体分子類似物質を創成できるのかなど,タンパク質科学における有用な情報を与えると期待されます。
A single mutation converts Alr5027 from cyanobacteria Nostoc sp. PCC 7120 to a heme-binding protein with heme-degrading ability, Nobuhiko Dojun, Kazuyoshi Muranishi, Koichiro Ishimori and Takeshi Uchida, J. Inorg. Biochem., 203, 110916 (11 pages) (2020) (DOI: 10.1016/j.jinorgbio.2019.
シアノバクテリアにはコレラ菌のヘム分解酵素HutZと配列が似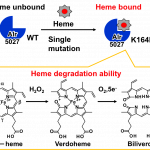
Specific heme binding to heme regulatory motifs in iron regulatory proteins and its functional significance,Yudai Nishitani, Hirotaka Okutani, Yukiko Takeda, Takeshi Uchida, Kazuhiro Iwai, Koichiro Ishimori 5 , J. Inorg. Biochem., 198, 110726203 (2019) (DOI: 10.1016/j.jinorgbio.2019.110726)
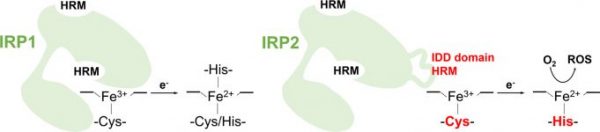
鉄は生体内で様々な機能を有している「生体金属」で、すべての生物にとって必須の遷移元素である。したがって、細胞内での鉄不足は多くの鉄含有蛋白質の機能不全や、病態としての貧血を引き起こす。一方、過剰な鉄も細胞内で活性酸素を産生し、種々の細胞内物質を損傷し、肝硬変や神経変性疾患を引き起こすと考えられている。このような鉄の細胞内での恒常性を維持するのが鉄制御蛋白質、Iron Response Regulator(IRP)であり、このIRPは細胞内へ鉄を取り込み、あるいは貯蔵する蛋白質の翻訳を制御するRNA結合制御蛋白質である。これまでの我々の研究から、IRPの2つの相同体であるIRP1、IRP2とも鉄ポルフィリン錯体であるヘムを結合することが分光学的に示され(Ogura et al., J. Inorg. Biochem., 2018, 182, 238-248)てきたが、その機能的意義は不明な点が多かった。本研究では、Native-PAGE法とOxyblot法といった生化学的手法を用いて、IRP1、IRP2ともヘムをそのヘム結合モチーフ(Heme Regulatory Motif)に特異的に結合し、そのヘム結合はいずれのIRPに対してもその結合RNA配列である鉄応答要素(Iron Responsive Element: IRE)への結合を阻害すること、また、IREを結合したIRP1、IRP2にヘムを添加するとIREからの解離が観測された。さらに、IRP2の場合には、IRP1には存在しない挿入配列、鉄依存性分解(Iron-dependent Degradation: IDD)ドメインに結合したヘムは、蛋白質部分の酸化修飾を引き起こし、IRP2の分解が進行することが示された。以上の結果は、IRPのIRE結合をヘムが制御することで、細胞内で利用できる鉄量が一定に維持されることを示しており、ヘムが細胞内の鉄恒常性維持のためのシグナル分子であることを意味している。今後、このようなヘムによる制御系の破綻と貧血、肝硬変、神経変性疾患といった鉄代謝異常の様々な病態との関連を明らかにすることで、新たな治療法や発病予防等の指針が得られると期待できる。
Role of conserved arginine in the heme distal site of HutZ from Vibrio cholerae in the heme degradation reaction, Takeshi Uchida, Nobuhiko Dojun, Kazuki Ota, Yukari Sekine, Yuina Nakamura, Sayaka Umetsu and Koichiro Ishimori , Arch Biochem Biophys., 677, 108165 (15 pages) (2019) (DOI: 10.1016/j.abb.2019.108165)
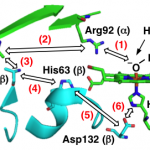
Role of His63 in HutZ from Vibrio cholerae in the heme degradation reaction and heme binding, Takeshi Uchida, Nobuhiko Dojun, Yukari Sekine and Koichiro Ishimori, Dalton Trans., in press
その結果、
Subunit-subunit interactions play a key role in the heme-degradation reaction of HutZ from Vibrio cholerae, Takeshi Uchida, Kazuki Ota, Yukari Sekine, Nobuhiko Dojun and Koichiro Ishimori, Dalton Trans., 2019, 48, 3973
HutZのヘム分解活性はpH依存的で、pH 6.0で最大であり、pHを高くするにつれ、活性は減少し、pH 8.0以上では10%以下の活性しかない。今回、
Structural insight into proline cis/trans isomerization of unfolded proteins catalyzed by the Trigger Factor chaperone
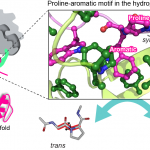
タンパク質のフォールディングにおいては,ジスルフィド結合やcis型プロリンなどの特定の部分構造の形成が重要になる場合が多いが,いくつかの分子シャペロンはこのような部分構造の形成を触媒する機能ドメインを有している.リボソーム近傍で変性状態の基質タンパク質と相互作用するTrigger Factor (TF) シャペロンはpeptidyl-prolyl cis/trans isomerase domain (TFPPD) を持ち,フォールディングの律速段階ともなりうるプロリンのcis/trans異性化反応を触媒する.このTFPPDの作用機序を解明するため,我々はまず,変性状態の基質タンパク質のプロリン残基を含む領域とTFPPDとの複合体立体構造をNMR法により決定した.その結果,基質タンパク質の疎水性領域に位置するプロリンと芳香族アミノ酸がTFPPDの疎水性部位によって認識されることが明らかになった.このプロリン-芳香族アミノ酸の配列は,TFが認識するプロリンに共通していることから,TFPPDはプロリン-芳香族アミノ酸を結合モチーフとすることが明らかになった.次に,分子動力学シミュレーションを行ったところ,cis/trans遷移の途中段階においてTF Ile195と基質タンパク質の間に過渡的な分子間水素結合が形成されることが明らかになった.さらに,変異体を用いた活性測定やNMR緩和解析によって,この分子間水素結合がTFの触媒活性に必須であることが示された.以上のようにTFは,プロリン-芳香族モチーフ中のプロリンに対して作用し,分子間水素結合による遷移状態の安定化によってcis/trans異性化を促進することによって,基質タンパク質の局所フォールディングを促進すると考えられる.
Oligomerization of a molecular chaperone modulates its activity, Tomohide Saio, Soichiro Kawagoe, Koichiro Ishimori, Charalampos G Kalodimos, eLife, 35731(2018)
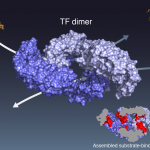
分子シャペロンは立体構造を形成する前の新生タンパク質を認識し,そのフォールディングを制御するが,その詳細なメカニズムは明らかになっていない.本研究では,大腸菌細胞質で機能するトリガーファクター (TF) シャペロンに着目し,TFが単量体・ニ量体のニ状態を切り替えながら多彩な機能を発揮していることを明らかにした.100 kDa ニ量体TFの高分解能立体構造をNMRによって決定した結果,TF上にある複数の基質結合サイトは,ニ量体形成によって部分的に覆い隠されることが明らかになった.これは,ニ量体TFは単量体よりも基質タンパク質との親和性が弱いという実験結果とも合致し,一見,TFニ量体が不活性型であることを示すかのように思われた.しかし,蛍光ストップト・フローにより基質との結合-解離速度を計測した結果,TFニ量体は単量体よりも基質との結合速度が速いことが明らかになった.さらに,基質タンパク質の折りたたみにおけるTFの影響を評価したところ,TFニ量体は基質タンパク質を変性状態に保持する能力が単量体よりも高いことが明らかになった.TF二量体の立体構造上では複数の基質結合サイトが互いに近接し,一つの大きな面を形成しているが,この基質結合サイトの集積が結合速度を上昇させていると考えられる.TFは二量体化によって速い結合速度を達成し,より効率的なタンパク質凝集抑制と変性タンパク質の輸送を可能にしていると考えられる.
Polyethylene glycol promotes autoxidation of cytochrome c, Wataru Sato, Takeshi Uchida, Tomohide Saio, and Koichiro Ishimori, Biochim. Biophys. Acta, 2018, 1862, 1339-1349
電子キャリアタンパク質シトクロムc(Cyt c)はATP合成に必須の過程に相当するミトコンドリア電子伝達
Redox-dependent axial ligand replacement and its functional significance in heme-bound iron regulatory proteins, Mariko Ogura, Ryosuke Endo, Haruto Ishikawa, Yukiko Takeda, Takeshi Uchida, Kazuhiro Iwai, Kazuo Kobayashi, Koichiro Ishimori, Journol of Inorg. Biochem., 2018, 182, 232-248
鉄制御蛋白質Iron regulatory proteins (IRPs)は、哺乳類の細胞内鉄濃度の調節因子であり、鉄の取り込みや貯蔵および利用に関与するタンパク質の翻訳量を制御することで、細胞内の鉄濃度を一定に保っている。IRPsにはアミノ酸配列のよく似たIRP1とIRP2が存在し、どちらもヘムをタンパク質の活性部位としてではなく、その機能を制御する分子として結合できるheme regulatory motif (HRM)部位をもっている。HRMへのヘムの結合はこれまでIRP2についてのみ報告されており、このHRMに結合したヘムは、還元剤の存在下、酸素分子と反応することで活性酸素種(ROS)を生成し、そのROSがアミノ酸残基の酸化反応を引き起こすことで、細胞内鉄濃度調節のシグナルが発信されると想定されている。しかし、このようなROSは反応性が高く、細胞内で生成すると周囲の生体組織を損傷する可能性がある。本論文では、IRP1のHRMにもヘムが選択的に結合することを見出し、そのヘム配位環境は、HRMをヘム結合部位に持つIRP2と非常に類似していることを明らかにした。しかし、IRP1のHRMへのヘムの結合はROSの生成やアミノ酸残基の酸化修飾を引き起こさず、これはヘムによるROS生成反応において重要な反応中間体が、IRP1では形成されないためであることを突き止めた。これにより、本論文では、細胞毒となりうるROSを生成せずにヘムを細胞内鉄濃度のシグナル分子として用いる新たな細胞内鉄濃度の制御機構を提唱した。
Heme Binding to Porphobilinogen Deaminase from Vibrio cholerae Decelerates the Formation of 1-Hydroxymethylbilane, Takeshi Uchida, Takumi Funamizu, Minghao Chen, Yoshikazu Tanaka,and Koichiro Ishimori, ACS Chem. Biol.,2018, 13(3), 750-760
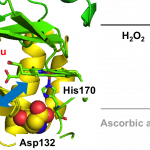
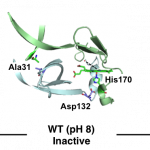
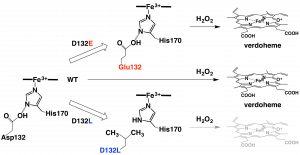
Heme Proximal Hydrogen Bonding between His170 and Asp132 Plays an Essential Role in the Heme Degradation Reaction of HutZ from Vibrio cholerae, Takeshi Uchida, Nobuhiko Dojun, Yukari Sekine, and Koichiro Ishimori, Biochemistry, 2017, 56 (21), 2723–2734.
西洋ワサビペルオキシダーゼ(HRP)
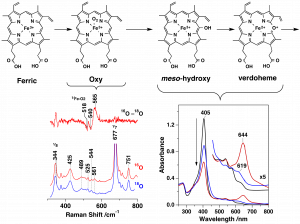
Reaction Intermediates in the Heme Degradation Reaction by HutZ from Vibrio cholerae, Takeshi Uchida, Yukari Sekine, Nobuhiko Dojun, Ariel Lewis, Izumi Ishigami, Toshitaka Matsui, Syun-Ru Yeh and Koichiro Ishimori, Dalton Trans., 2017, 46, 8104
我々はすでに、
Heme Iron Coordination Structure of Heme Transport Protein HutB from Vibrio cholerae, Takeshi Uchida, Takumi Funamizu, Mariko Ogura, and Koichiro Ishimori, Bull. Chem. Soc. Jpn., 2017, 90, 8, 924-930
HutBは遺伝子配列からコレラ菌の外膜と内膜に挟まれた領域に
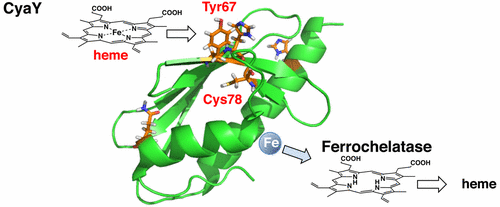
The iron chaperone protein CyaY from Vibrio cholerae is a heme-binding protein, Takeshi Uchida, Noriyuki Kobayashi, Soichiro Muneta, and Koichiro Ishimori, Biochemistry, 2017, 56, 2425-2434
CyaYは生体分子の酸化還元中心である鉄-硫黄クラスターやヘ
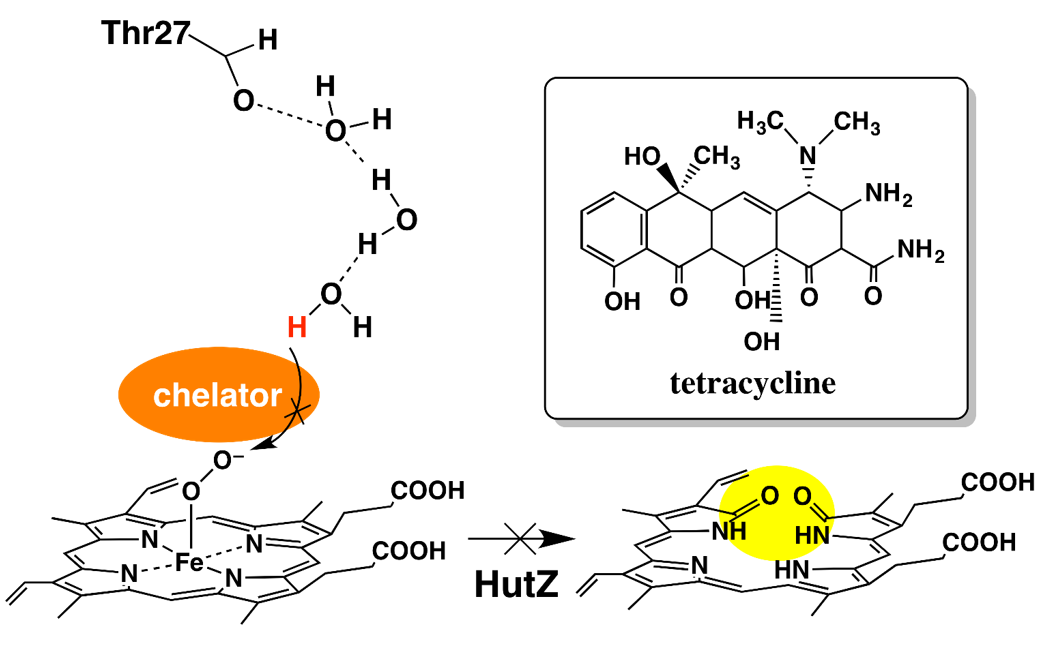
Iron Chelators Inhibit the Heme-Degradation Reaction by HutZ form Vibrio cholerae, Nobuhiko Dojun, Yukari Sekine, Koichiro Ishimori, Takeshi Uchida, Dalton Trans., 2017, 46, 5147
病原菌は増殖のため鉄獲得を必要とする。宿主である人の体内に存在する鉄の多くは、赤血球に存在するヘモグロビン中に鉄-ポルフィリン錯体であるヘムとして存在する。コレラ菌ではヘムの獲得タンパク質を利用しヘムを獲得し、ヘムの分解酵素であるHutZがヘムを分解し鉄を取り出す。今回、このHutZによるヘム分解反応がキレート剤により抑制されることを発見した。分光学的手法を用いてキレート剤が活性部位近傍の水分子の構造を変えることにより、酸素結合体の水酸化過程を抑制していることを明らかにした。HutZの酵素活性の阻害はコレラ菌の鉄獲得の抑制につながると考えられることから、キレート能を持つ化合物がコレラ菌を含む多くの病原菌の治療薬となる可能性が示された。
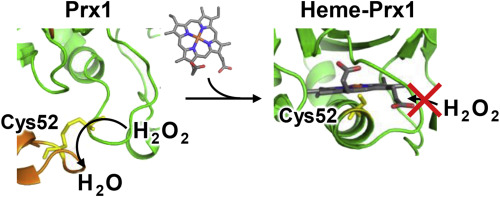
Dual role of the active-center cysteine in human peroxiredoxin 1: Peroxidase activity and heme binding, Y. Watanabea, K. Ishimori, and T. Uchida, Biochem Biophys Res Commun., 483, 930 (2017)
ペルオキシレドキシン (PRX1)は二つのCys間でS-
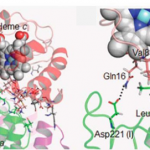
Energetic Mechanism of Cytochrome c – Cytochrome c Oxidase Electron Transfer Complex Formation under Turnover Conditions Revealed by Mutational Effects and Docking Simulation, W. Sato, S. Hitaoka, K. Inoue, M. Imai, T. Saio, T. Uchida, K. Shinzawa-Itoh, S. Yoshikawa, K. Yoshizawa, and K. Ishimori, J.Biol.Chem., 291, 15320-15331(2016)
細胞内エネルギー通貨に例えられるATPは、糖の分解などで生じた電子が細胞小器官ミトコンドリアの内膜に埋め込まれている一連の呼吸鎖タンパク質を介して酸素分子にまで伝達される「電子伝達系」の駆動によって合成される。この生理的に重要な電子伝達系において、シトクロムc酸化酵素(CcO)は酸素分子を水分子に還元することで電子伝達を終結させる役割を担い、その反応に要する電子はシトクロムc(Cyt c)から伝達される。本研究ではCyt cからCcOへ電子伝達する際に形成されるCyt c-CcO複合体に着目し、この複合体の形成に寄与するアミノ酸残基について検討するため、変異体活性測定並びに会合のドッキングシミュレーションを行った。その結果、Cyt cの多くのLys残基に起因する静電相互作用の複合体形成へのエネルギー的寄与はその大部分が脱溶媒和の効果によって相殺されるために極めて乏しく、複合体の安定化は主に少数の疎水性アミノ酸残基による疎水性相互作用に起因していることが新たに示された。このようなCyt c-CcO間に形成される特異的且つ弱い疎水性相互作用は、タンパク質間で迅速な結合-解離を可能にする点でCyt cからCcOへの恒常的な電子伝達に寄与していると考えられる。
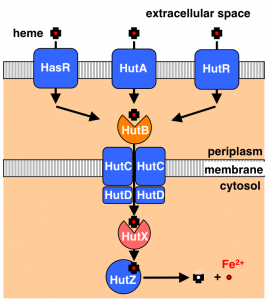
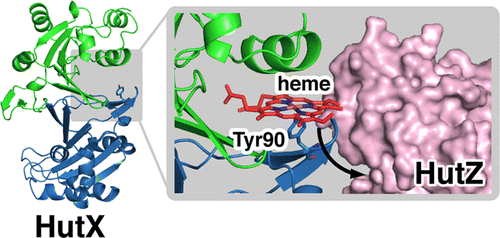
Cytoplasmic Heme-Binding Protein (HutX) from Vibrio cholerae Is an Intracellular Heme Transport Protein for the Heme-Degrading Enzyme, HutZ, Y. Sekine, T. Tanzawa, Y. Tanaka, K. Ishimori, and T. Uchida, Biochemistry, 55, 884 (2016)
Investigation of the redox-dependent modulation of structure and dynamics in human cytochrome c, M. Imai, T. Saio, H. Kumeta, T. Uchida, F. Inagaki and K. Ishimori, Biochem.Biophys.Res.Commun., 469(4), 978 (2016)
細胞のエネルギー工場であるミトコンドリア、そこでは糖類の分解によって得らえた電子がミトコンドリア内膜に埋め込まれた複数の膜タンパク質の間で伝達されることによって ATP合成が行われています。私たちはこの電子伝達のメカニズム解明を目指し、特に電子伝達の最終段階を担う電子伝達ヘムタンパク質のCytochrome c (Cyt c) と巨大な分子量で複雑な構造をもつ膜結合酸化酵素Cyt c Oxidase (CcO) の間での電子伝達について研究を進めています。ここでは電子を持った還元状態のCyt cがCcOに選択的に結合し、電子を受け渡して酸化状態となったCyt cは速やかにCcOから解離することで、酸素分子を水に還元すると考えられていますが、その詳細な制御メカニズムは未だ明らかにされていませんでした。私たちは、Cyt c とCcOの結合がどのように制御され、どのようにして効率的な電子伝達が可能になっているのかを明らかにするために、溶液NMR法を用いてCyt cの立体構造とそのダイナミクスを酸化状態、還元状態の両方について解析しました。Cyt cの立体構造解析の結果、CcOとの相互作用面に加え、その反対側にもCyt cの酸化還元状態に依存した立体構造変化が観測されました。さらにダイナミクスの面からは、CcOとの相互作用面よりも、むしろその反対側の領域が柔軟な構造で、構造的な「揺らぎ」があることが明らかになりました。相互作用面における構造変化はCcOとの相互作用の制御に重要であると容易に想像できますが、その反対側で観測された構造変化と「揺らぎ」は予想外で興味深く、これらの構造的特性がどのようにCcOとの相互作用の制御、さらには電子の伝達に関与しているのか、今後の研究での解明が期待されます。(T. S.)
A Dye-Decolorizing Peroxidase from Vibrio cholerae, T. Uchida, M. Sasaki, Y. Tanaka, and K. Ishimori, Biochemistry, 54, 6610 (2015)
色素分解型ペルオキシダーゼ(DyP)は、
Unique Heme Environmental Structures in Heme-regulated Proteins Using Heme as the Signaling Molecule, K. Ishimori and Y. Watanabe, Chem.Lett., 43(11), 1680 (2014)
タンパク質の補欠分子族として最もよく知られているものの一つに、鉄とポルフィリンとよばれる環状分子からなる錯体「ヘム」が挙げられる。ヘムの機能としては、ヘモグロビンによる酸素運搬(酸素分子の結合)やシトクロムcによる電子伝達(酸化還元中心)に代表されるような活性中心としての機能は広く知られている。一方、最近の研究により、このような活性中心としての機能に加え、タンパク質の活性を制御するリガンド、すなわちシグナル分子としても機能していることが明らかとなってきた。ヘムをシグナル分子として用いると考えられるタンパク質はバクテリアからヒトまで多様な生物種に存在し、そのヘム結合部位として、共通する特徴的なアミノ酸配列を持っていると考えられている。また、その機能も遺伝子発現制御からイオンチャネル、概日リズムなど多岐にわたり、ヘムの生理機能における新たな側面として注目されている。本総説では、ヘムタンパク質の構造解析に強力な手法である分光学を用いてなされた研究を中心に、ヘムによって活性制御されるタンパク質”Heme-regulated protein”の特異なヘム配位環境やその周辺構造について最新の議論をまとめた。(Y.W.)
A heme degradation enzyme, HutZ, from Vibrio cholerae, T. Uchida, Y. Sekine, T. Matsui, M. Ikeda-Saito, and K. Ishimori, Chem. Commun., 48, 6741 (2012)
コレラは代表的な感染症の一つであり、経口摂取により体内に侵入したコレラ菌が腸内で増殖し、それらが産生するコレラ毒素により、下痢や嘔吐などを発症する。菌はエネルギー産生に鉄を含む蛋白質を利用することから、増殖に鉄イオンを必要とする。人体に感染した菌体は、宿主から鉄を獲得するため、その獲得機構の解明は病原菌の感染防止等につながる重要なテーマである。体内に存在する鉄の約70%はヘモグロビン中にヘムとして存在するため、ヘムがコレラ菌の主要な鉄源となる。コレラ菌はHutと呼ばれる一群の蛋白質を利用し、ヘムを細菌内に取り込む。遺伝子解析の結果、HutZと呼ばれるタンパク質がヘム分解酵素であることを見出した。そこで、HutZの発現系を構築し、そのヘム分解活性を調べた。HutZはヒトがもつヘム分解酵素とアミノ酸配列に相同性がないにも関わらず、ヒトのヘム分解酵素に特徴的なベルドヘムと呼ばれる中間体を経由し、ヘムを分解することがわかった。さらに、活性中心近傍に他のヘム分解酵素に存在しない水素結合のネットワークが存在し、その水素結合の強度を変化させることにより、酵素活性を制御していることが明らかにした。
Structural features of small benzene clusters (C6H6)n (n≤30) as investigated with the all-atom OPLS potential, H. Takeuchi, J. Phys. Chem. A, 116, 10172 (2012)
最も単純な芳香族炭化水素クラスターであるベンゼンクラスターの構造に関して研究は少ししか進んでいない。本論文では、OPLSポテンシャルを用いて得られた構造を報告する。最安定構造と多くのエネルギーの低い構造を自作の構造摂動ヒューリステック法による求めた。クラスター構造の特徴とクラスターが大きくなる時の成長過程を調べた。その際には、局所構造解析と回転定数による構造特徴抽出を援用した。等方的な相互作用を示す原子のクラスターではクラスター 内の基本構造が二十面体であるが、ベンゼンクラスターでは分子間相互作用の異方性により基本構造がそれから大きく歪んでいることがわかった。ベンゼンの二体分布関数を調べると、分布がほぼ等方的な液体状態と異なり、クラスターではかなり異方的な分布を示した。以前の超音速ジェット中でのクラスターの実験結 果を解釈する際には、分子の位置が大きく異なる構造が複数存在することはなく、分子の向きが変化している構造が共存していると考えられる。
NMR Basis for Interprotein Electron Transfer Gating between Cytochrome c – Cytochrome c Oxidase, K. Sakamoto, M. Kamiya, M. Imai, K. Shinzawa-Ito, T. Uchida, K. Kawano, S. Yoshikawa, and K. Ishimori, Proc. Natl. Acad. Sci. U.S.A., 108, 12271 (2011)
多くの生物にとって生命を維持するために必要な酸素は細胞内に送られ、ミトコンドリアという細胞内小器官で水に変換されます。この過程には、細胞内で糖類を分解すること(解糖系)で取りだされた電子が必要で、この電子がミトコンドリアの内膜部分に埋め込まれた蛋白質の複合体間を伝達されることによって、細胞内のエネルギー通貨とよばれるATPが生成し、ATPは生物のエネルギー源として利用されています。私たちはこのようなミトコンドリア内の電子伝達系(呼吸鎖)の仕組みを明らかにして、酸素呼吸生物のエネルギー生産機構を分子レベルで解明しようとしていますが、最近、この電子伝達系の最終段階で酸素分子から水分子を生成させるシトクロムc酸化酵素への電子伝達反応について、多次元NMR法を用いて、その電子受け取りの機構を明らかにしました。この電子伝達反応では、まず、電子運搬蛋白質であるシトクロムcという蛋白質がシトクロムc酸化酵素に結合しますが、結合するとすぐに電子が受け渡されるのではなく、電子が受け渡されやすい構造に変化してから電子が渡され、電子がシトクロムcからシトクロムc酸化酵素に受け渡されるとまた構造変化が起こり、今度は電子が逆流しない構造に変化します。この結果から私たちは、蛋白質の構造が変化することで効率よく電子の受け渡しができる機構「Gating Mechanism」を提唱し、このような機構はATP生産機構において非常に重要な役割を果たしています。